
【題目】五氧化二釩用作冶金添加劑,占五氧化二釩總消耗量的 80%以上,其次是用作有機化工的催化劑。為了增加V2O5 的利用率,我們從廢釩催化劑(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一種生產工藝流程示意圖:
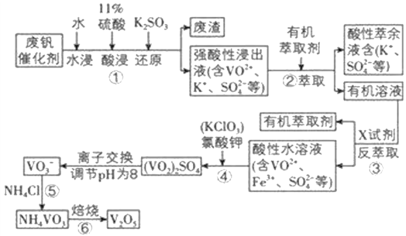
部分含釩物質在水中的溶解性如表所示,回答下列問題:
物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
(1)①中廢渣的主要成分是 __________________________;①中V2O5 發生反應的離子方程式為 ___________________________ 。
(2)②、③中的變化過程可簡化為(下式中的R 表示 VO2+或 Fe3+,HA 表示有機萃取劑的主要成分)R2(SO4)n(水層)+2nHA(有機層) 2RA(有機層)+ nH2SO4(水層)。②中萃取時必須加入適量堿,其原因是 ______________________;實驗室進行萃取操作使用的玻璃儀器為 ______________________。
(3)實驗室用的原料中V2O5 占 6%(原料中的所有釩已換算成 V2O5)。取 100 g 該廢釩催化劑按工業生產的步驟進行實驗,當加入 100 mL 0.1 molL -1 的KClO3 溶液時,溶液中的釩恰好被完全處理,假設以后各步釩沒有損失,則該實驗中釩的回收率是 __________________[M(V2O5)=182 gmol -1]。
(4)25℃時,取樣進行實驗分析,得到釩沉淀率和溶液 pH 之間的關系如表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
釩沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
試判斷在實際生產時,⑤中加入 NH4Cl 調節溶液的最佳 pH為____________;若釩沉淀率為 93.1%時不產生 Fe(OH)3 沉淀,則此時溶液中 c(Fe3+)≤____________ (已知:25℃時Ksp[Fe(OH)3]=2.6×10 -39)。
【答案】SiO2 V2O5+4H++SO32-=2VO2++SO42-+2H2O 加入堿,中和H2SO4,使平衡正移 分液漏斗、燒杯 91.0% 1.7 2.6×10 -3 molL -1
【解析】
生產流程:廢釩催化劑(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等),據物質的水溶性確定,V2O5和SiO2難溶于水,因為亞硫酸根具有還原性,酸性條件下,能被五氧化二釩氧化生成硫酸根離子,離子反應方程式為:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,過濾得到濾渣為二氧化硅,強酸性浸出液含有VO2+、K+、SO42-,加入有機萃取劑萃取分液得到有機溶液中VO2+,再加入X試劑進行反萃取分液,分離出有機層得到水層是含VO2+、Fe3+、SO42-的酸性水溶液,根據Rn+(水層)+nHA(有機層)![]() RAn(有機層)+nH+(水層),加入的堿會和平衡體系中的氫離子反應促進平衡正向進行,加入硫酸抑制平衡正向進行,氯酸鉀具有氧化性,能將VO2+氧化為VO2+,加入氨水,調節溶液pH到最佳值,得到NH4VO3,最后焙燒得到五氧化二釩即可。
RAn(有機層)+nH+(水層),加入的堿會和平衡體系中的氫離子反應促進平衡正向進行,加入硫酸抑制平衡正向進行,氯酸鉀具有氧化性,能將VO2+氧化為VO2+,加入氨水,調節溶液pH到最佳值,得到NH4VO3,最后焙燒得到五氧化二釩即可。
(1)根據上述分析可知①中廢渣的主要成分是二氧化硅,①中V2O5 發生反應的離子方程式為V2O5+4H++SO32-=2VO2++SO42-+2H2O,故答案為:SiO2;V2O5+4H++SO32-=2VO2++SO42-+2H2O;
(2)反萃取時,根據VOSO4 (水層)+2HA2(有機層)![]() VOA2(有機層)+H2SO4(水層)可知,為提高②中萃取百分率,則加入堿中和硫酸使平衡正移、多次連續萃取,提高釩的萃取率;萃取分液操作時,用到的玻璃儀器有分液漏斗和燒杯,故答案為:加入堿,中和H2SO4,使平衡正移;分液漏斗、燒杯;
VOA2(有機層)+H2SO4(水層)可知,為提高②中萃取百分率,則加入堿中和硫酸使平衡正移、多次連續萃取,提高釩的萃取率;萃取分液操作時,用到的玻璃儀器有分液漏斗和燒杯,故答案為:加入堿,中和H2SO4,使平衡正移;分液漏斗、燒杯;
(3)結合得失電子守恒和原子守恒配平得到加入氯酸鉀時發生的反應的離子方程式為ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,根據該離子方程式可得如下關系:3V2O5~6VO2+~ ClO3-,100mL0.1mol/L的KClO3溶液中ClO3-物質的量為n(ClO3-)=0.1L×0.1mol/L=0.01mol,則對應的V2O5的物質的量為0.03mol,質量為0.03mol×182g/mol=5.46g,則該實驗中釩的回收率是![]() ,故答案為:91.0%;
,故答案為:91.0%;
(4)從沉淀率和pH關系可知,隨pH增大,沉淀率先增大后減小,故沉淀率最大的pH即為最佳pH,pH=1.7時釩的沉淀率最大為98.8%,加入氨水調節溶液的最佳pH為為1.7,若釩沉淀率為93.1%時不產生Fe(OH)3沉淀,此時溶液pH=2,計算氫氧根離子濃度c(OH-)=10-12mol/L,K[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)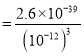 =2.6×10-3mol/L,故答案為:1.7;2.6×10-3mol/L。
=2.6×10-3mol/L,故答案為:1.7;2.6×10-3mol/L。


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】如圖是用兩個石墨作電極,電解飽和Na2SO4溶液的裝置,U形管內的電解液中事先加有酚酞指示劑。回答下列問題:
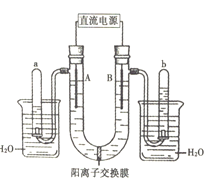
(1)根據圖示中倒扣試管內的液面高度,判斷直流電源左端為______極,Na+通過陽離子交換膜移動的方向為______(填“左→右”或“右→左”)。
(2)電解過程中,有關電極附近溶液顏色變化中正確的是______(填序號)。
①A管溶液由無色變為紅色
②B管溶液由無色變為紅色
③A管溶液不變色
④B管溶液不變色
(3)寫出B管中發生的電極反應______。
(4)檢驗b管中氣體的方法及現象是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅礦是一種銅鐵硫化物,化學式為CuFeS2,它是工業上煉銅的主要原料。某化學小組對其中的硫、鐵、銅的含量進行測定。
Ⅰ.硫的含量測定。
(1)采用裝置A,在高溫下將10.0g礦樣中的硫轉化為SO2。
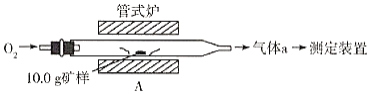
若在裝置A反應中,氧化劑與還原劑的物質的量之比為19:6,灼燒后A中留下黑色固體,則反應的化學方程式為__________。
(2)將氣體a通入測硫裝置中(如圖),然后采用沉淀法測定硫的含量。

①KMnO4溶液氧化SO2的離子方程式為________________。
②向反應后的溶液中加入過量的BaCl2溶液,過濾,洗滌沉淀并干燥,稱重為23.3g,則該礦樣中硫的質量分數為__________。
Ⅱ.鐵、銅的含量測定。
向A中灼燒后的固體中加入稀硫酸,加熱溶解,過濾,將濾液分為兩等份。
(3)取其中一份加入過量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},過濾、洗滌、灼燒、稱重為1.5 g。實驗過程中,加入過量的氨水得到的沉淀是___________(填化學式);灼燒時除用到三腳架、酒精燈和玻璃棒外,還要用到________________。
(4)①將另一份溶液調至弱酸性,先加入NH4F,使Fe3+生成穩定的![]() ,其目的是_____
,其目的是_____
②加入過量KI溶液,使Cu2+生成CuI沉淀,同時析出定量的I2。
③再用1.00 molL-1 Na2S2O3標準溶液滴定生成的I2,以___________作指示劑。若消耗的Na2S2O3標準溶液為25.00 mL,則礦樣中銅的質量分數是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在溫度、容積均相同的 3 個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下表所示:
容器 | 甲 | 乙 | 丙 |
反應物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的濃度(mol/L) | c1 | c2 | c3 |
反應的能量變化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
體系壓強(Pa) |
|
|
|
反應物轉化率 | α1 | α2 | α3 |
下列說法不正確的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列方程式書寫正確的是
A.HCO3-在水溶液中的電離方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.乙烷燃燒熱的熱化學方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】炭黑是霧霾中的重要顆粒物,研究發現它可以活化氧分子,生成活化氧。活化過程的能量變化模擬計算結果如右圖所示。活化氧可以快速氧化 SO2。下列說法不正確的是
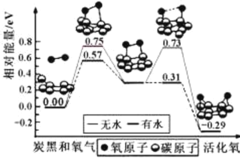
A.每活化一個氧分子放出0.29eV能量
B.水可使氧分子活化反應的活化能降低0.42eV
C.氧分子的活化是O-O的斷裂與C-O鍵的生成過程
D.炭黑顆粒是大氣中SO2轉化為SO3的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生的實驗報告中,描述合理的是( )
A.用量筒量取25.20mL的稀鹽酸
B.用pH試紙測得NaClO溶液的pH約為11
C.將CuCl2溶液蒸發濃縮、降溫結晶、過濾得到氯化銅晶體
D.用25mL酸式滴定管量取出15.00mLKMnO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KO2的晶體結構和NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,則關于KO2晶體結構的描述正確的是( )
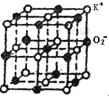
A.如圖一個超氧化鉀小晶胞中含有4個KO2
B.和K+距離相同且最近的O2-構成的多面體是正六面體
C.和K+距離相同且最近的K+有8個
D.和K+距離相同且最近的O2-共有8個
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com