
【題目】有機物M具有抗氧化、抗腫瘤作用,其結構簡式如圖所示。下列有關M的說法正確的是( )
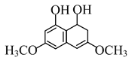
A.一定條件下M可發生加成、氧化、消去等反應
B.M與Na、NaOH溶液、NaHCO3溶液均能發生反應
C.1molM與濃溴水充分反應,最多消耗Br2的物質的量為4mol
D.M分子中含有1個手性碳原子
【答案】AD
【解析】
A.M的結構中含有酚羥基、醇羥基、酯基、醚鍵、苯環、碳碳雙鍵,醇羥基在一定條件下可發生氧化反應、消去反應,碳碳雙鍵和苯環在一定條件下可發生加成反應,故A正確;
B.M的結構中含有酚羥基、醇羥基、酯基、醚鍵、苯環、碳碳雙鍵,醇羥基、酚羥基可與Na反應,酯基、酚羥基可與NaOH溶液反應,酚羥基的酸性弱與碳酸,則該有機物中的官能團與NaHCO3溶液不能發生反應,故B錯誤;
C.M的結構中有碳碳雙鍵與溴水反應,酚羥基的鄰位和對位可與溴水反應,1molM與濃溴水充分反應,最多消耗Br2的物質的量為3mol,故C錯誤;
D.一個碳原子上結合四個不同的原子或原子團,該碳原子為手性碳原子,M分子中如圖所示: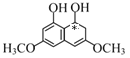 (號所示的為手性碳),含有1個手性碳原子,故D正確;
(號所示的為手性碳),含有1個手性碳原子,故D正確;
答案選AD。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】在1L的密閉容器中充入2mol N2和7mol H2,發生反應N2+3H2=2NH3,保持其他條件不變,相同時間內測得NH3的濃度與溫度的關系如圖所示.下列敘述不正確的是
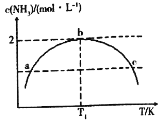
A.該反應是放熱反應
B.a、c兩點對應的壓強 Pa<Pc
C.溫度為T1時,N2的平衡轉化率為50%
D.溫度為T1時,再加入1mol N2和1mol NH3,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是![]()
A.60g丙醇中存在的共價鍵總數為10NA
B.50mL 12mol·L-1鹽酸與足量MnO2共熱,轉移的電子數為0.3 NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反應中,生成28g N2時,轉移的電子數為3.75 NA
2HNO3+4N2↑+9H2O反應中,生成28g N2時,轉移的電子數為3.75 NA
D.235g核素![]() 發生裂變反應:
發生裂變反應:![]() ,凈產生的中子 (
,凈產生的中子 (![]() )數為14 NA
)數為14 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應中實際上包含氧化和還原兩個過程。下面是一個還原過程的反應式:NO3-+4H++3e-=NO↑+2H2O;已知KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四種物質中的一種物質(甲)能使上述還原過程發生。
(1)寫出并配平該反應的離子方程式;用“單線橋法”標出電子轉移的方向和數目: _______________。
(2)反應中硝酸體現了_________、_________性質。
(3)反應中若轉移3mol電子,則在標況下產生的氣體體積是________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于離子方程式或離子共存的說法中正確的是![]()
A.向 ![]() 溶液中加入稀
溶液中加入稀 ![]() :
:![]()
B.![]() 溶液中加入足量
溶液中加入足量 ![]() 溶液:
溶液:![]()
C.某溶液中只存在以下 4種離子:![]() 、
、![]() 、
、![]() 、R離子
、R離子![]() 忽略微量的
忽略微量的 ![]() ,且濃度均為
,且濃度均為 ![]() ,則 R離子可能為
,則 R離子可能為 ![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存。
能大量共存。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Co2O3常用于作氧化劑,在生產中有重要應用。
(1)一定條件下,0.996gCo2O3與15.00mL0.1mol·L-1的Na2S2O3溶液恰好完全反應,生成Co2+和一種含硫物質,該含硫物質中硫元素的化合價是___。
(2)Co2O3、PbO2、KMnO4均可與濃鹽酸反應生成Cl2,同時分別生成Co2+、Pb2+和Mn2+。若生成等物質的量的Cl2,所需Co2O3、PbO2和KMnO4的物質的量之比為___。
(3)為測定某Co2O3樣品中Co2O3的純度(雜質不參與反應),現進行如下實驗:
步驟1:稱取樣品2.000g于錐形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反應。
步驟2:向步驟1所得溶液中逐滴滴加0.0500mol·L-1KMnO4標準溶液至終點,消耗KMnO4標準溶液的體積為20.00mL。
已知步驟1、2中所涉及物質的轉化分別為:Co3+![]() Co2+、MnO
Co2+、MnO![]()
![]() Mn2+
Mn2+
通過計算確定Co2O3樣品中Co2O3的質量分數___(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一種有機物。
(1)尿素中所含元素的電負性最大的是______,尿素分子間的氫鍵可表示為______。
(1)尿素可用于制有機鐵肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①與鐵同周期且未成對電子數與Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化學鍵______![]() 填序號
填序號![]() 。
。
A.離子鍵B.金屬鍵C.配位鍵D.σ鍵E.π鍵
③![]() 中N原子雜化后的價電子排布圖為______,
中N原子雜化后的價電子排布圖為______,![]() 的空間構型為______。
的空間構型為______。
Ⅱ.Mg2NiH4是一種貯氫的金屬氫化物
(3) Mg2NiH4可通過氫化鎂和鎳單質球磨制成。在Mg2NiH4晶胞中,Ni原子占據如圖的頂點和面心, Mg2+處于如圖八個小立方體的體心。
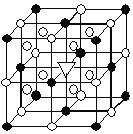
①Mg2NiH4中H的化合價為______。
②Mg2+位于Ni原子形成的______ (填“八面體空隙”或“四面體空隙”)。
③若晶體的密度為d g·cm-3,Mg2NiH4的摩爾質量為M g·mol-1,則Mg2+和Ni原子的最短距離為______nm(用含d、M的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com