
 光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成.
光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成.分析 (1)實驗室通常用二氧化錳與濃鹽酸共熱的方法制備氯氣;
(2)根據CH4、H2、和CO的燃燒熱分別寫出燃燒的熱化學方程式,利用蓋斯定律書寫該反應的熱化學方程式,據此計算;
(3)CHCl3中碳為+2價,COCl2中碳為+4價,故H2O2中氧元素化合價由-1價降低為-2價,生成H2O,由電子轉移守恒與原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化學計量數為1:1:1:1,根據原子守恒故含有HCl生成;
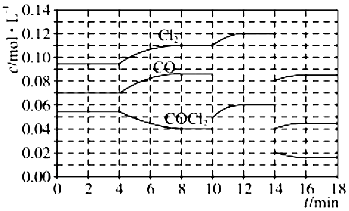
(4)①由圖可知,8min時COCl2的平衡濃度為0.04mol/L,Cl2的平衡濃度為0.11mol/L,CO的平衡濃度為0.085mol/L,代入平衡常數表達式K=$\frac{c(CO)c(C{l}_{2})}{c(COC{l}_{2})}$計算;
②第8min時反應物的濃度比第2min時減小,生成物濃度增大,平衡向正反應方向移動,4min瞬間濃度不變,不可能為改變壓強、濃度,應是改變溫度,結合溫度對平衡影響判斷;
③由圖可知,10min瞬間Cl2濃度不變,CO的濃度降低,故改變條件為移走CO,降低CO的濃度,平衡常數不變,與8min到達平衡時的平衡常數相同,由圖可知,12min時到達平衡時Cl2的平衡濃度為0.12mol/L,CO的平衡濃度為0.06mol/L,根據平衡常數計算c(COCl2);
④根據化學反應速率的定義,可知反應在2~3 min和12~13 min處于平衡狀態,CO的平均反應速率為0;
⑤在5~6 min和15~16 min時反應溫度相同,在相同溫度時,該反應的反應物濃度越高,反應速率越大,但15~16 min時各組分的濃度都小,因此反應速率小.
解答 解:(1)二氧化錳與濃鹽酸在加熱條件下生成氯化錳、氯氣與水制取氯氣,反應方程式為:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案為:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)根據CH4、H2、和CO的燃燒熱分別寫出燃燒的熱化學方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ•mol-1,
利用蓋斯定律將②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ•mol -1,
即生成2molCO,需要吸熱247.3 KJ,那么要得到1立方米的CO,吸熱為$\frac{1000L}{22.4L/mol}$×$\frac{247.3KJ/mol}{2}$=5.52×103KJ;
故答案為:5.52×103KJ;
(3)CHCl3中碳為+2價,COCl2中碳為+4價,故H2O2中氧元素化合價由-1價降低為-2價,生成H2O,由電子轉移守恒與原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化學計量數為1:1:1:1,根據原子守恒故含有HCl生成,故反應方程式為CHCl3+H2O2═COCl2↑+HCl+H2O,
故答案為:CHCl3+H2O2═COCl2↑+HCl+H2O;
(4)①由圖可知,8min時COCl2的平衡濃度為0.04mol/L,Cl2的平衡濃度為0.11mol/L,CO的平衡濃度為0.085mol/L,K=$\frac{c(CO)c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,
故答案為:0.234mol/L;
②由第2min反應溫度變為第8min反應溫度時,生成物濃度增大、反應物濃度減小,平衡向正反應方向移動,正反應是吸熱反應,升高溫度,平衡向正反應方向移動,所以T(2)<T(8),
故答案為:<;
③由圖可知,10min瞬間Cl2濃度增大,CO的濃度降低,故改變條件為移走CO,降低CO的濃度,平衡常數不變,與8min到達平衡時的平衡常數相同,由圖可知,12min時到達平衡時Cl2的平衡濃度為0.12mol/L,CO的平衡濃度為0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L;
故答案為:0.031;
④根據化學反應速率的定義,可知反應在2~3 min和12~13 min處于平衡狀態,CO的平均反應速率為0,在5~6min時,反應向正反應進行,故CO的平均反應速率為:v(5~6)>v(2~3)=v(12~13),
故答案為:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min時反應溫度相同,在相同溫度時,該反應的反應物濃度越高,反應速率越大,但15~16 min時各組分的濃度都小,因此反應速率小,即v(5~6)>v(15~16),
故答案為:<;在相同溫度時,該反應的反應物濃度越高,反應速率越大.
點評 本題考查化學平衡計算、化學平衡移動、平衡常數、濃度隨時間變化曲線等,理解圖象中曲線變化趨勢及曲線變化可能改變的條件是解本題關鍵,是對學生綜合能力的考查,題目難度中等.


科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O和SO2 | B. | HCl和KCl | C. | Na2O2和 H2O2 | D. | NH4F和NaF |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由一種元素組成的物質一定是單質 | |
| B. | 任何純凈物都是有一種元素組成的 | |
| C. | 含有氧元素的化合物一定是氧化物 | |
| D. | 有不同種元素組成的純凈物是化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-) | B. | c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.6mol | B. | 0.9mol | ||
| C. | 大于0.4mol,小于0.6mol | D. | 大于0.6,小于0.9mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同質量、不同密度的N2O 和CO2 | |
| B. | 相同體積、相同密度的CO 和 C2 H4 | |
| C. | 相同溫度、相同壓強、相同體積的O2和O3 | |
| D. | 相同壓強、相同質量的C2H4和C3H6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com