
【題目】下圖是元素周期表的一部分,A—I九種元素在元素周期表中的位置如圖:

請回答下列問題:
(1)B在周期表中的位置_______;E的離子結構示意圖______。
(2)C的最高價氧化物對應的水化物與C的氣態氫化物發生反應,生成物中含有的化學鍵類型是_____。
(3)G、I的最高價氧化物對應的水化物的化學式是_________、_____。
(4)A、D形成的化合物中只含極性鍵的物質的電子式為______。
(5)F、H的簡單離子半徑較大的是______(用離子符號表示),H、I的氣態氫化物穩定性較強的是____(填化學式)。
【答案】第二周期ⅣA族 ![]() 離子鍵、共價鍵 Al(OH)3 HClO4
離子鍵、共價鍵 Al(OH)3 HClO4 ![]() S2- HCl
S2- HCl
【解析】
由元素在周期表中位置,可知A為H、B為C、C為N、D為O、E為Na、F為Mg、G為Al、H為S、I為Cl,根據元素周期律進行分析判斷。
由元素在周期表中位置,可知A為H、B為C、C為N、D為O、E為Na、F為Mg、G為Al、H為S、I為Cl。
(1)B為C元素,在元素周期表中第二周期ⅣA族;E為Na元素,Na+離子結構示意圖為![]() ;
;
(2)C為N元素,其最高價氧化物對應的水化物HNO3與C的氣態氫化物NH3發生反應,生成物NH4NO3中銨根離子與硝酸根離子之間形成離子鍵,銨根離子中氮原子與氫原子之間、硝酸根離子中氮原子與氧原子之間形成共價鍵,故NH4NO3中含有的化學鍵類型是離子鍵、共價鍵;
(3)G、I分別為Al元素和Cl元素,它們的最高價氧化物對應的水化物的化學式分別是Al(OH)3、HClO4;
(4)A、D形成的化合物中只含極性鍵的物質H2O的電子式為![]() ;
;
(5)F、H的簡單離子Mg2+、S2-,后者多一個電子層,離子半徑較大的是S2-,非金屬性越強,氣態氫化物的穩定性越強,故H、I的氣態氫化物H2S、HCl的穩定性較強的是HCl。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(1)![]() 中心原子軌道的雜化類型為___________;
中心原子軌道的雜化類型為___________;![]() 的空間構型為_____________(用文字描述)。
的空間構型為_____________(用文字描述)。
(2)Fe2+基態價電子排布圖為__________________。
(3)與O3分子互為等電子體的一種陰離子為_____________(填化學式)。
(4)N2分子中σ鍵與π鍵的數目比n(σ)∶n(π)=__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、E、F是三個不同短周期的五種主族元素,其原子序數依次增大。A和E最外層電子數相同,1mol單質E跟足量酸完全反應時,產生標準狀況下11.2L氫氣;C2-與E+具有相同的電子層結構;B、C和F在周期表中相鄰,B、C同周期,C、F同主族;請回答下列問題:
(1)寫出E元素在周期表中的位置:______
(2)畫出F原子的結構示意圖:______
(3)用電子式表示化合物E2C的形成過程:______
(4)寫出金屬銅與元素F的最高價氧化物的水化物的濃溶液在加熱條件下反應的化學方程式______
(5)A、B兩種元素形成的離子型化合物的化學式為:______
(6)P和Q兩種物質都是由A、C、E、F四種元素組成的酸式鹽,等物質的量的P和Q恰好完全反應,寫出該反應的離子方程式:______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于苯的敘述正確的是
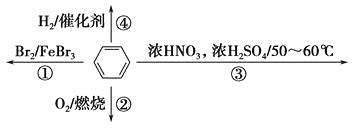
A. 反應①為取代反應,有機產物與水混合浮在上層
B. 反應②為氧化反應,反應現象是火焰明亮并帶有濃煙
C. 反應③為取代反應,有機產物是一種烴
D. 反應④中1 mol苯最多與3 mol H2發生加成反應,因為每個苯分子含有三個碳碳雙鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.下面是石蠟油在熾熱碎瓷片的作用下產生乙烯并檢驗乙烯性質的實驗。請回答下列問題:
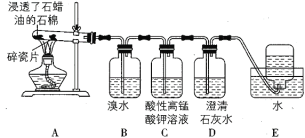
(1)A中碎瓷片的作用是____________
(2)B裝置中反應的化學方程式為_______
(3)C裝置中可觀察到的現象是_____________
(4)D中的現象是_______________
(5)除去甲烷中乙烯的方法是將氣體依次通過盛有____、濃硫酸的洗氣瓶。
a 酸性高錳酸鉀溶液 b 水 c 溴水 d 氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯是一種重要的化工原料,苯可以進行如下轉化。部分反應條件、反應物、生成物已省略

(1)反應①的化學方程式是________。
(2)A的結構簡式是________名稱是________。
(3)反應③所需反應物除A外,還需要________,反應條件是________。
(4)僅用水鑒別苯和溴苯的方法是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不同條件下,用O2氧化一定濃度的FeCl2溶液過程中所測的實驗數據如圖所示。下列分析或推測不合理的是
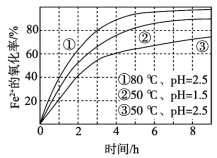
A. Fe2+的氧化率隨時間延長而逐漸增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,溫度越高,Fe2+氧化速率越快
D. 氧化過程的離子方程式為:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,在200mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
時間(min) | 1 | 2 | 3 | 4 | 5 |
氫氣體積(mL)(標準狀況) | 50 | 120 | 232 | 290 | 310 |
①上述實驗過程中,反應速率最大時間段是________(選填字母作答),該時間段反應速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分鐘時間段以鹽酸的濃度變化來表示的該反應速率___________________(假設反應過程中溶液體積不變)。
(2)某溫度下在容積為1L密閉容器中,X、Y、Z三種氣態物質的物質的量隨時間變化曲線如圖。

①該反應的化學方程式是______________________________________________。
②該反應達到平衡狀態的標志是________。
A.X的濃度不再改變
B.Y的體積分數在混合氣體中保持不變
C.容器內氣體的總壓強保持不變
D.容器內氣體的總質量保持不變
③反應進行到2min時,Y的轉化率為_____________。
(3)燃料電池可以將氣體燃料和氧氣直接反應產生電能,其效率高、污染低,是一種很有前途的能源利用方式。但傳統燃料電池使用氫氣為燃料,而氫氣既不易制取又難以儲存,導致燃料電池成本居高不下。科研人員嘗試用便宜的甲烷、乙烷等碳氫化合物為燃料,設計出新型燃料電池,使其成本大大低于以氫氣為燃料的傳統燃料電池。請寫出以甲烷為燃料、硫酸為電解質溶液的該新型燃料電池工作時負極的電極反應方程式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)將等質量的鎂分別與足量的CO2、O2、N2、空氣中充分燃燒,反應前后固體增重由大到小的順序為___。
(2)在常溫下,實驗室用固體亞硫酸鈉和中等濃度的硫酸制取SO2氣體。將制得的SO2氣體通入紫色石蕊試液,可觀察到的現象為___。
(3)在常溫下,把NO氣體壓縮到1.01×108Pa,在一個體積固定的容器里加熱到50℃,發現氣體的壓力迅速下降,壓力降至略小于原壓力![]() 就不再改變,已知其中一種產物為N2O,寫出上述變化的化學方程式___。
就不再改變,已知其中一種產物為N2O,寫出上述變化的化學方程式___。
(4)按如圖進行實驗,試管中裝有NO,然后緩慢地通入84mLO2,充分反應后液面高度不變,則原試管中裝有NO的體積為___。
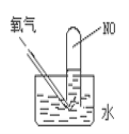
(5)標況下,將一定體積的盛滿NO、NO2、O2的混合氣體的試管倒立于水槽中,水充滿整個試管,則試管內的溶液的物質的量濃度范圍是(假定試管內溶液不擴散)為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com