
【題目】(1)寫出下列物質在水溶液中電離的方程式:
HNO3_______________________________;HClO___________________________________;
NaHCO3__________________________________、___________________________________。
(2)在25℃、101kPa下,1g甲醇燃燒生成CO2和液態水時放熱22.68kJ。則表示甲醇燃燒熱的熱化學方程式為___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列問題:
①上述反應中屬于放熱反應的是________________________________________________。
②H2的燃燒熱為_____________________,C的燃燒熱為____________________________。
③燃燒l0gH2 生成液態水,放出的熱量為________________________________________。
④CO的燃燒熱為___________,其熱化學方程式為_________________________________。
【答案】 HNO3=H++NO3- HClO![]() H++ClO- NaHCO3=Na++HCO3- HCO3-
H++ClO- NaHCO3=Na++HCO3- HCO3-![]() H++CO32- CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 ①②③④ 285.8 kJ·mol-1 393.5 kJ·mol-1 1429 kJ 283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
H++CO32- CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 ①②③④ 285.8 kJ·mol-1 393.5 kJ·mol-1 1429 kJ 283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
【解析】(1).硝酸是強酸,屬于強電解質,在水溶液中完全電離,電離方程式為:HNO3=H++NO3-;次氯酸是弱酸,屬于弱電解質,在水溶液中部分電離,方程式為:HClO![]() H++ClO-;NaHCO3是鹽,屬于強電解質,在溶液中完全電離生成鈉離子和碳酸氫根離子,碳酸氫根離子部分電離生成氫離子和碳酸根離子,方程式為:NaHCO3=Na++HCO3-,HCO3-
H++ClO-;NaHCO3是鹽,屬于強電解質,在溶液中完全電離生成鈉離子和碳酸氫根離子,碳酸氫根離子部分電離生成氫離子和碳酸根離子,方程式為:NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-,故答案為:HNO3=H++NO3-;HClO
H++CO32-,故答案為:HNO3=H++NO3-;HClO![]() H++ClO-;NaHCO3=Na++ HCO3-;HCO3-
H++ClO-;NaHCO3=Na++ HCO3-;HCO3-![]() H++CO32-;
H++CO32-;
(2).1mol甲醇的質量是1mol×32g/mol=32g,因1g甲醇燃燒生成CO2和液態水時放熱22.68kJ,則1mol甲醇燃燒時放出熱量(32×22.68)kJ=725.76kJ,則表示甲醇燃燒熱的熱化學方程式為:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1,故答案為:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1;
(3).①.放熱反應的△H<0,所以上述四個反應都是放熱反應,故答案是:①②③④;
②.燃燒熱指的是1mol純物質完全燃燒生成穩定的氧化物時所放出的熱量,則C、H元素完全燃燒應分別生成CO2(g)、H2O(l),所以H2的燃燒熱為285.8 kJ·mol-1,C的燃燒熱為393.5 kJ·mol-1,故答案為:285.8 kJ·mol-1;393.5 kJ·mol-1;
③.根據氫氣的燃燒熱可知,1molH2完全燃燒生成液態水時放出熱量285.8kJ,10g H2的物質的量是5mol,則燃燒10g H2生成液態水時放出熱量(5×285.8)kJ=1429kJ,故答案為:1429 kJ;
④.根據蓋斯定律,將④-③得:CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1,根據燃燒熱的定義可知,CO的燃燒熱為283 kJ·mol-1,故答案為:283 kJ·mol-1;CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1。


 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 共價鍵一定只存在于共價化合物中
B. CH3CH2CH3光照下與氯氣反應,只生成1種一氯代烴
C. 苯在濃硫酸催化下與濃硝酸的反應是取代反應
D. 石油裂解和裂化的目的相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知用硫酸酸化的草酸(H2C2O4)溶液能與KMnO4溶液反應.某化學小組研究發現,少量MnSO4可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:
(1)常溫下,探究不同的初始pH和草酸溶液濃度對反應速率的影響,設計如下實驗,則A= , C= , E=
實驗編號 | 溫度 | 初始pH | 0.1mol/L草酸溶液體積/mL | 0.01mol/LKMnO4 | 蒸餾水體積/mL | 待測數據(混合液褪色時間/s) |
① | 常溫 | 1 | 20 | 50 | 30 | t1 |
② | 常溫 | A | B | C | 30 | t2 |
③ | 常溫 | 2 | 40 | D | E | t3 |
(2)該反應的離子方程式 .
(3)若t1<t2 , 則根據實驗①和②得到的結論是 .
(4)小組同學發現每組實驗反應速率隨時間的變化總是如圖,其中t1~t2時間內速率變快的主要原因可能是: 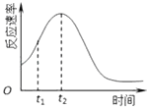
①;②
(5)化學小組用滴定法測定KMnO4溶液物質的量濃度:取ag草酸晶體(H2C2O42H2O,摩爾質量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于錐形瓶中,加入適量稀H2SO4酸化,再用KMnO4溶液滴定至終點,重復滴定三次,平均消耗KMnO4溶液VmL.滴定到達終點的現象是:;實驗中所需的定量儀器有(填儀器名稱).該KMnO4溶液的物質的量濃度為mol/L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學興趣小組對某品牌牙膏中摩擦劑成分及其含量進行以下探究:
查得資料:該牙膏摩擦劑由碳酸鈣、氫氧化鋁組成;牙膏中其他成分遇到鹽酸時無氣體產生.
(1)摩擦劑中氫氧化鋁的定性檢驗.
取適量牙膏樣品,加水充分攪拌、過濾.
往濾渣中加入過量NaOH溶液,過濾,濾液中通入過量二氧化碳,請寫出通入過量二氧化碳反應的離子方程式是 .
(2)牙膏樣品中碳酸鈣的定量測定.
利用如圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,測定C中生成的BaCO3沉淀質量,以確定碳酸鈣的質量分數.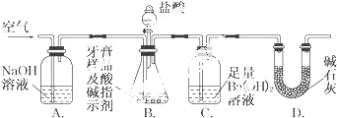
依據實驗過程回答下列問題:
(i)實驗過程中需持續緩緩通入空氣.其作用除了可攪拌B、C中的反應物外,還有
(ii)C中反應生成BaCO3的化學方程式是
(iii)下列各項措施中,不能提高測定準確度的是(填標號).
a.在加入鹽酸之前,應排凈裝置內的CO2氣體
b.滴加鹽酸不宜過快
c.在A~B之間增添盛有濃硫酸的洗氣裝置
d.在B~C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
(iv)實驗中準確稱取8.00g樣品三份,進行三次測定,測得BaCO3平均質量為3.94g.則樣品中碳酸鈣的質量分數為
(v)有人認為不必測定C中生成的BaCO3質量,只要測定裝置C在吸收CO2前后的質量差,就可以確定碳酸鈣的質量分數.實驗證明按此方法測定的結果明顯偏高,原因是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應2SO2(g)+O2(g)2SO3(g) 最終能增大反應速率的措施是( )
A.降低體系溫度
B.增大容器容積
C.減小O2的濃度
D.升高體系溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某模擬“人工樹葉”電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為O2和燃料(C3H8O).下列說法正確的是( ) 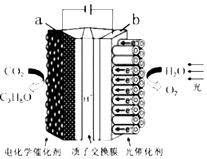
A.a電極的反應為:3CO2+18H++18e﹣=C3H8O+5H2O
B.該裝置工作時,H+從b極區向a極區遷移
C.每生成1molO2 , 有44gCO2被還原
D.該裝置將化學能轉化為光能和電能
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com