
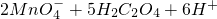 ═
═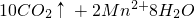 ,下列分析錯誤的是
,下列分析錯誤的是


科目:高中化學(xué) 來源: 題型:閱讀理解
 對于反應(yīng)A(g)?2B(g)△H>0,在溫度為T1、T2時,平衡體系中B的體積分?jǐn)?shù)隨壓強變化的曲線如圖所示.回答下列各題.
對于反應(yīng)A(g)?2B(g)△H>0,在溫度為T1、T2時,平衡體系中B的體積分?jǐn)?shù)隨壓強變化的曲線如圖所示.回答下列各題.| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
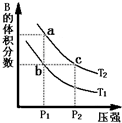
 對于可逆反應(yīng):2A(g)+B(g)?2C(g),分別測定反應(yīng)在不同溫度下達到平衡時B的轉(zhuǎn)化率,繪制了如圖所示的曲線,圖中a、b、c三點分別表示不同的時刻狀態(tài).下列分析正確的是( )
對于可逆反應(yīng):2A(g)+B(g)?2C(g),分別測定反應(yīng)在不同溫度下達到平衡時B的轉(zhuǎn)化率,繪制了如圖所示的曲線,圖中a、b、c三點分別表示不同的時刻狀態(tài).下列分析正確的是( )| A、該反應(yīng)的△H<0 | B、b點時混合氣體的平均摩爾質(zhì)量不再變化 | C、增大壓強,可使a點達到T1溫度下平衡狀態(tài) | D、c點表示的狀態(tài):v(正)<v(逆) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
 乙醇是重要的化工產(chǎn)品和液體燃料,可以利用下列反應(yīng)制取乙醇.
乙醇是重要的化工產(chǎn)品和液體燃料,可以利用下列反應(yīng)制取乙醇.| 催化劑 |
| 催化劑 |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com