
【題目】下列物質A-F是我們熟悉的單質或化合物,其中A、B均是常見的金屬,且B的合金用量最大;E在常溫下是黃綠色氣體;適當的條件下,它們之間可以發生如圖所示的轉化。

(1)G溶液中溶質的化學式為_____________。
(2)請寫出反應D→F的化學方程式:_________。
(3)檢驗F中金屬陽離子的常用試劑是______________(填物質的化學式);現象是____________。
(4)E物質可與石灰乳反應制取漂白粉,寫出漂白粉的有效成分_________。
(5)寫出C與過量氫氧化鈉溶液反應的離子方程式_______________。
(6)若向D溶液中滴加氫氧化鈉溶液,現象是:____,反應過程中的化學方程式為:____,______。
【答案】NaAlO2 2FeCl2+ Cl2= 2FeCl3 KSCN 溶液呈血紅色 Ca(ClO)2 Al3+ +4OH-=AlO2-+2H2O 先產生白色沉淀,后白色沉淀變為灰綠色,最后變為紅褐色 FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
B的合金用量最大,所以B為Fe;E在常溫下是黃綠色氣體,所以E為Cl2;鹽酸與鐵反應生成FeCl2,FeCl2與Cl2反應生成的F為FeCl3;金屬A與鹽酸反應后生成的鹽,與適量的NaOH溶液反應能生成白色沉淀,白色沉淀還能溶于NaOH,所以A為Al單質,C為AlCl3溶液,G為NaAlO2溶液。
(1)根據分析可知,G即為偏鋁酸鈉溶液,溶質的化學式為NaAlO2;
(2)根據分析可知,D為FeCl2,與E即Cl2反應后生成FeCl3,方程式為:![]() ;
;
(3)檢驗Fe3+常用硫氰化鉀溶液,Fe3+遇SCN-生成血紅色物質;
(4)漂白粉中的有效物質為次氯酸鈣;
(5)通過分析可知,C為AlCl3溶液,與過量的NaOH溶液反應,生成偏鋁酸鈉和水,離子方程式為:![]() ;
;
(6)通過分析可知,D的溶液為FeCl2溶液,FeCl2會與NaOH溶液反應生成很不穩定的白色Fe(OH)2沉淀,沉淀會迅速的被氧化為Fe(OH)3,轉化的現象為:白色沉淀先轉變為灰綠色,最終變為紅褐色;相關的方程式還有:![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】工業上由黃銅礦(主要成分CuFeS2)冶煉銅的主要流程如下:

(1)氣體A中的大氣污染物可選用下列試劑中的_______吸收.
a.濃H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈紅色,說明溶液中存在__________(填離子符號),檢驗溶液中還存在Fe2+的方法是_____________________________(注明試劑、現象).
(3)由泡銅冶煉粗銅的化學反應方程式為________________________.
(4)以CuSO4溶液為電解質溶液進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,下列說法正確的是_________.
a.電能全部轉化為化學能
b.粗銅接電源正極,發生氧化反應
c.溶液中Cu2+向陽極移動
d.利用陽極泥可回收Ag、Pt、Au等金屬
(5)利用反應2Cu+O2+2H2SO4═2CuSO4+2H2O可制備CuSO4,若將該反應設計為原電池,其正極電極反應式為______________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關問題,與鹽的水解有關的是( )
①NH4Cl與ZnCl2溶液可作焊接金屬中的除銹劑②用NaHCO3與Al2(SO4)3兩種溶液可作泡沫滅火劑③草木灰與銨態氮肥不能混合施用④實驗室盛放碳酸鈉溶液的試劑瓶不能用磨口玻璃塞⑤加熱蒸干AlCl3溶液得到Al2O3固體
A. ①②③ B. ②③④⑤ C. ②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的鹽酸,恰好使混合物完全溶解,放出224mL(標準狀況)的氣體,所得溶液中加入KSCN溶液無血紅色出現。若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的質量是( )
A. 11.2gB. 5.6gC. 2.8gD. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴乙烷在不同溶劑中與NaOH發生不同類型的反應,生成不同的反應產物。
(1)寫出溴乙烷與NaOH水溶液共熱的反應方程式:_______________,某同學取少量溴乙烷與NaOH水溶液反應后的混合溶液,向其中滴加AgNO3溶液,加熱,產生少量沉淀。該同學由此得出溴乙烷與NaOH水溶液反應,生成了溴化鈉,你認為是否合理,原因:____________________。
(2)寫出溴乙烷與NaOH乙醇溶液共熱的反應方程式:________,反應中生成的氣體可以用如圖所示裝置檢驗,現象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化學方程式: __________________________,X是比乙烯相對分子質量大14的乙烯的同系物,工業上用X生產塑料的化學方程式為:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值。下列說法正確的是
A. 1.4gC2H4、C3H6 的混合氣體中,所含碳原子總數為 0. lNA
B. 1.0 mol CH4 與 Cl2 在光照下反應生成的 CH3Cl 分子數為 1.0NA
C. 標準狀況下,22. 4LC2H6 中所含極性共價鍵的數目為 7NA
D. 50mL l2mol·L 的濃鹽酸與足量 MnO2 反應,轉移電子總數為 0. 3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷和水蒸氣反應的產物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH、CO2+3H2
CH3OH、CO2+3H2![]() CH3OH+H2O,300 mol CH4完全反應后的產物中,加入100 mol CO2后合成甲醇。若獲得甲醇350 mol,殘留氫氣120 mol,計算CO2的轉化率_________。
CH3OH+H2O,300 mol CH4完全反應后的產物中,加入100 mol CO2后合成甲醇。若獲得甲醇350 mol,殘留氫氣120 mol,計算CO2的轉化率_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2S2O5是常用的防腐劑和漂白劑。可利用煙道氣中的SO2生產Na2S2O5,其流程如下:
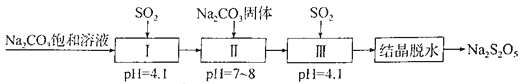
下列說法正確的是
A. 上述制備過程所涉及的物質中只有一種酸性氧化物
B. Na2S2O5作防腐劑和SO2作漂白劑時,均表現還原性
C. 上述流程中的Na2CO3飽和溶液和Na2CO3固體不可互換
D. 實驗室模擬“結晶脫水”時用到的儀器只有蒸發皿、玻璃棒、燒杯、漏斗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應6NO2+8NH3===7N2+12H2O構成電池的裝置如圖所示。此方法既能實現有效清除氮氧化物的排放,減輕環境污染,又能充分利用化學能。下列說法正確的是()

A. 電流從左側電極經過負載后流向右側電極
B. 為使電池持續放電,離子交換膜需選用陰離子交換膜
C. 電極A極反應式為2NH3-6e-===N2+6H+
D. 當有4.48 L NO2被處理時,轉移電子數為0.8NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com