
在1.0 L密閉容器中放入0.10 mol A(g),在一定溫度進行如下反應應:
A(g) B(g)+C(g)
△H =+85.1 kJ· mol-1
B(g)+C(g)
△H =+85.1 kJ· mol-1
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
|
時間t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
|
總壓強p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列問題:
(1)欲提高A的平衡轉化率,應采取的措施為 。
(2)由總壓強P和起始壓強P0計算反應物A的轉化率α(A)的表達式為 。
平衡時A的轉化率為 ,列式并計算反應的平衡常數K 。
(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),
n總= mol,n(A)= mol。
②下表為反應物A濃度與反應時間的數據,計算a=
|
反應時間t/h |
0 |
4 |
8 |
16 |
|
c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析該反應中反應反應物的濃度c(A)變化與時間間隔(△t)的規律,得出的結論是 ,由此規律推出反應在12h時反應物的濃度c(A)為 mol·L-1
(1)升高溫度、降低壓強
(2)α(A)=(  -1)×100%;94.1%;K=
-1)×100%;94.1%;K= =1.5;
=1.5;
(3)①0.1× ;0.1×(2-
;0.1×(2- );
);
②0.051;每間隔4小時,A的濃度為原來的一半。0.013
【解析】
試題分析:(1)根據反應是放熱反應特征和是氣體分子數增大的特征,要使A的轉化率增大,平衡要正向移動,可以采用升高溫度、降低壓強的方法。
(2)反應前氣體總物質的量為0.10mol,令A的轉化率為α(A),改變量為0.10α(A) mol,根據差量法,氣體增加0.10α(A)mol,由阿伏加德羅定律列出關系:
 =
= α(A)=(
α(A)=(
 -1)×100%;α(A)=(
-1)×100%;α(A)=( -1)×100%=94.1%
-1)×100%=94.1%
平衡濃度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,K= =1.5
=1.5
(3)①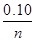 =
= n=0.1×
n=0.1× ;其中,n(A)=0.1-(0.1×
;其中,n(A)=0.1-(0.1× -0.1)=0.1×(2-
-0.1)=0.1×(2- )
)
②n(A)=0.1×(2- )=0.051 C(A)=0.051/1=0.051mol/L
)=0.051 C(A)=0.051/1=0.051mol/L
每間隔4小時,A的濃度為原來的一半。當反應12小時時,C(A)=0.026/2=0.013mol/L
考點:考察化學平衡知識,涉及平衡移動,轉化率、平衡常數、平衡計算、反應速率、表格數據分析。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2013年全國普通高等學校招生統一考試理科綜合能力測試化學(新課標Ⅱ卷帶解析) 題型:計算題
在1.0 L密閉容器中放入0.10molA(g),在一定溫度進行如下反應應:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反應時間t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題沖刺第6講 化學反應速率和化學平衡練習卷(解析版) 題型:填空題
在1.0 L密閉容器中放入0.10 mol A (g),在一定溫度進行如下反應:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
總壓強p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列問題:
(1)欲提高A的平衡轉化率,應采取的措施為________。
(2)由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式為________________________________________________________________________,平衡時A的轉化率為________,列式并計算反應的平衡常數K_______________。
(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),n總=________mol,n(A)=________mol。
②下表為反應物A濃度與反應時間的數據,計算a=__________________。
反應時間t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析該反應中反應物的濃度c(A)變化與時間間隔(Δt)的規律,得出的結論是________,由此規律推出反應在12 h時反應物的濃度c(A)為________mol·L-1。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年廣東省江門市高三調研測試理綜化學試卷(解析版) 題型:填空題
對大氣污染物SO2、NOx進行研究具有重要環保意義。請回答下列問題:
(1)為減少SO2的排放,常采取的措施是將煤轉化為清潔氣體燃料。
已知:H2(g)+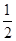 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1
C(s)+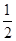 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
寫出焦炭與水蒸氣反應的熱化學方程式: 。
(2)已知汽缸中生成NO的反應為:N2(g)+O2(g) 2NO(g)
△H
2NO(g)
△H 0,若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在1.0 L密閉容器內經過5s反應達到平衡,測得NO為8.0×10-4 mol。
0,若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在1.0 L密閉容器內經過5s反應達到平衡,測得NO為8.0×10-4 mol。
①5s內該反應的平均速率ν(NO) = (保留2位有效數字);在1300oC 時,該反應的平
衡常數表達式K= 。
②汽車啟動后,汽缸溫度越高,單位時間內NO排放量越大,原因是 。
(3)汽車尾氣中NO和CO的轉化。當催化劑質量一定時,增大催化劑固體的表面積可提高化學反應速率。右圖表示在其他條件不變時,反應2NO(g)+2CO(g)
 2CO2(g)+N2(g) 中,NO的濃度
2CO2(g)+N2(g) 中,NO的濃度
c(NO)隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。

①該反應的△H 0 (填“>”或“<”)。
②若催化劑的表面積S1>S2,在右圖中畫出c(NO) 在T1、S2條件下達到平衡過程中的變化曲線(并作相應標注)。
查看答案和解析>>
科目:高中化學 來源:2013年全國普通高等學校招生統一考試理科綜合能力測試化學(新課標Ⅱ卷解析版) 題型:計算題
在1.0 L密閉容器中放入0.10molA(g),在一定溫度進行如下反應應:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
|
時間t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
|
總壓強p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列問題:
(1)欲提高A的平衡轉化率,應采取的措施為 。
(2)由總壓強P和起始壓強P0計算反應物A的轉化率α(A)的表達式為 。
平衡時A的轉化率為 ,列式并計算反應的平衡常數K 。
(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),n總= mol,n(A)= mol。
②下表為反應物A濃度與反應時間的數據,計算a=
|
反應時間t/h |
0 |
4 |
8 |
16 |
|
C(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析該反應中反應反應物的濃度c(A)變化與時間間隔(△t)的規律,得出的結論是 ,
由此規律推出反應在12h時反應物的濃度c(A)為 mol·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com