
【題目】聚合硫酸鐵(PFS)是一種高效的無機高分子絮凝劑。某工廠利用經浮選的硫鐵礦燒渣(有效成分為 Fe2O3 和 Fe3O4)制備 PFS,其工藝流程如下圖所示。
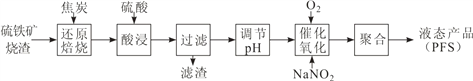
(1)CO是“還原焙燒”過程的主要還原劑。下圖中,曲線表示 4 個化學反應 a、b、c、d 達到平衡時氣相組成和溫度的關系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分別是 Fe2O3、Fe3O4、FeO、Fe 穩定存在的區域。a屬于__________(填“吸熱反應”或“放熱反應”);570℃時,d 反應的平衡常數 K=___________________。
(2)800℃,混合氣體中CO2的體積分數為40%時,Fe2O3用CO還原焙燒過程中發生的主要的化學反應方程式:________________________________________________
(3)若“酸浸”時間過長,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃時,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,為避免“催化氧化”過程中產生副產物 Fe(OH)3,應調節浸出液的 pH≤___________。
(5)FeSO4 溶液在空氣中會緩慢氧化生成難溶的Fe(OH)SO4 ,該反應的離子方程式_____________________________________.
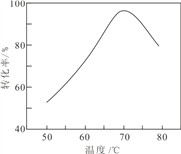
(6)“催化氧化”過程中,用 NaNO2 作催化劑(NO 起實質上的催化作用)時,溫度與Fe2+轉化率的關系如右圖所示(反應時間相同),Fe2+ 轉化率隨溫度的升高先上升后下降的原因是___________________________________________.
【答案】 放熱反應 1 Fe2O3+CO=FeO+CO2 Fe2+易被空氣中的 O2 氧化成 Fe3+ 1.6 4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4↓ 溫度升高,反應速率增大;溫度過高,NO 氣體逸出,轉化率下降
【解析】(1)a曲線隨著溫度的升高,CO的百分含量增大,平衡逆向移動,即a屬于放熱反應;570℃時,一氧化碳和二氧化碳百分含量相等,即濃度相等,d反應的平衡常數![]() ;正確答案:放熱反應; 1。
;正確答案:放熱反應; 1。
(2)根據圖像可知,800℃,混合氣體中CO2的體積分數為40%時,Fe2O3用CO還原焙燒過程中發生的主要的化學反應方程式:Fe2O3+CO=FeO+CO2 ;正確答案:Fe2O3+CO=FeO+CO2 。
(3)若“酸浸”時間過長,浸出液中 Fe2+含量反而降低,主要原因是: Fe2+易被空氣中的O2 氧化成 Fe3+(或其他合理答案);正確答案:Fe2+易被空氣中的 O2 氧化成 Fe3+ (或其他合理答案)。
(4)![]() ,c(OH-)=10-12.4mol/L,c(H+)=10-1.6mol/L,應調節浸出液的
,c(OH-)=10-12.4mol/L,c(H+)=10-1.6mol/L,應調節浸出液的![]() ;正確答案:1.6。
;正確答案:1.6。
(5)FeSO4 中+2價鐵在空氣中會被氧氣氧化為+3價鐵,生成難溶的Fe(OH)SO4,反應的離子方程式4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4↓;正確答案:4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4↓。
(6)根據圖像可知,70℃為最佳溫度,Fe2+轉化率隨溫度的升高先上升后下降的原因是:溫度升高,反應速率增大;溫度過高,NO 氣體逸出,轉化率下降;正確答案:溫度升高,反應速率增大;溫度過高,NO 氣體逸出,轉化率下降。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】Ⅰ已知銅在常溫下能被HNO3溶解。反應方程式為: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)請將上述反應改成離子方程式,并用單線橋法表示電子得失的方向和數目________________。
(2)若生成448mL的NO(標準狀況下),則該過程中轉移的電子是___________mol。
(3)被還原的硝酸占參加反應硝酸的比例為___________。
Ⅱ某反應體系有反應物和生成物共7種物質:C、H2SO4、K2CrO4、K2SO4、CO2 、Cr2(SO4)3和H2O。已知該反應中發生如下過程:C→CO2。該反應的化學方程式:__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽在化學工業中有重要的應用,請回答下列問題:
(1)用化學方程式表示配制FeCl3溶液時常加入濃鹽酸的原因______________________________________________
(2)常溫下,在pH=3的Al2(SO4)3溶液與pH=11的Na2S溶液中,水電離出來的c(OH﹣)之比為______,將兩溶液混合后,產生白色沉淀和有臭雞蛋味的氣體,其反應的離子方程式為_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物質的量濃度由小到大的順序是______________________________________________________ (用序號表示)
(4)已知t℃時①AgCl的Ksp=2×10﹣10;②在t℃時,Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示.下列正確的是_______

A.在飽和Ag2CrO4溶液中加入K2CrO4可使溶液由Y點到X點
B.在t℃時Ag2CrO4的Ksp為1×10-12
C.在t℃時反應:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常數為2.5×107
2AgCl(s)+CrO42-(aq)的平衡常數為2.5×107
D.在t℃時以0.01mol/L的AgNO3溶液滴定20mL濃度均為0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從某含Br—廢水中提取Br2的過程包括:過濾、氧化、萃取(需選擇合適萃取劑)及蒸餾等步驟。已知:
物質 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸點/℃ | 58.76 | 76.8 | 215~217 |
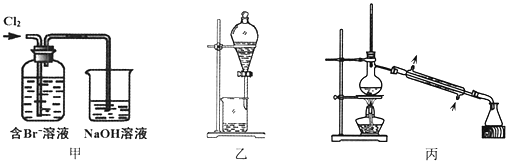
下列說法不正確的是
A. 甲裝置中Br—發生的反應為:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲裝置中NaOH溶液每吸收0.1mol Cl2,轉移0.1mol e—
C. 用乙裝置進行萃取,溶解Br2的有機層在下層
D. 用丙裝置進行蒸餾,先收集到的是Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應在金屬冶煉工業中還沒有得到應用的是( )
A. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
B. 2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
C. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. Al2O3+3C![]() 2Al+3CO↑
2Al+3CO↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D為四種可溶性鹽,它們的陽離子分別是此![]() 、
、![]() 、
、![]() 、
、![]() 中的一種,陰離子分別是
中的一種,陰離子分別是![]() 、
、![]() 、
、![]() 、
、![]() 中的一種(離子在物質中不能重復出現)。現做如下實驗:
中的一種(離子在物質中不能重復出現)。現做如下實驗:
①把四種鹽分別溶于盛有蒸餾水的四支試管中,只有C的溶液呈藍色;
②向①的四支試管中分別加入鹽酸, B的溶液中有沉淀生成, D的溶液中有無色無味的氣體逸出。
根據①②實驗現象回答下列問題:
(1)寫出A、C的化學式:A__________,B__________,C_________。
(2)寫出鹽酸與D反應的離子方程式:_____________________________________。
(3)寫出C與![]() 溶液反應的離子方程式:________________________________。
溶液反應的離子方程式:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究硫元素及其化合物的性質具有重要意義。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如下圖(忽略溶液體積的變化、H2S的揮發)。

①pH=11時,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,當溶液pH=________時,Mn2+開始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)25 ℃,兩種酸的電離常數如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HCO![]() 的電離常數表達式K=________。
的電離常數表達式K=________。
②0.10 mol·L-1Na2SO3溶液中離子濃度由大到小的順序為___________________。
③H2SO3溶液和NaHCO3溶液反應的主要離子方程式為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料是人類賴以生存和發展的重要物質基礎。請回答下列問題:
(1)有機合成材料的出現是材料發展史上的一次重大突破。人們常說的三大合成材料是指__________________、__________________、__________________。
(2)聚氯乙烯的商品名為PVC,其結構簡式為____________________,PVC管材中還需要加入具有特殊用途的添加劑,如_______________、________________等,因為PVC具有_____________性,所以由它制得的材料可反復加工、多次使用。
(3)合金是生活中常見的材料,某合金具有密度小、強度高的優良性能,常用于制造門窗框架,該合金中含量最高的金屬為_______(填元素符號),該元素在周期表中的位置為______________________________。
(4)玻璃是一種常見的硅酸鹽材料,制備普通玻璃的原料有CaCO3、_______和_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(2018·安徽省合肥市高三第三次教學質量檢測)H2S在重金屬離子處理、煤化工等領域都有重要應用。請回答:
Ⅰ.H2S是煤化工原料氣脫硫過程的重要中間體,反應原理為
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知斷裂1mol氣態分子中的化學鍵所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)計算表中x=_______。
(2)T℃時,向VL容積不變的密閉容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),發生上述兩個反應。
①在T℃時測得平衡體系中COS為0.80 mol,H2為0.85 mol,則T℃時反應ⅰ的平衡常數K=_______(保留2位有效數字)。
②上述反應達平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),則再次達平衡后H2的體積分數_______(填“增大”、“減小”或“不變”);若升高溫度,則CO的平衡體積分數_______(填“增大”、“減小”或“不變”),其理由是_______。
Ⅱ.H2S在高溫下分解制取H2,同時生成硫蒸氣。
(3)向2L密閉容器中加入0.2molH2S,反應在不同溫度(900~1500℃)下達到平衡時,混合氣體中各組分的體積分數如下圖所示,則在此溫度區間內,H2S分解反應的主要化學方程式為_______;在1300℃時,反應經2min達到平衡,則0~2min的反應速率v(H2S)=_______。
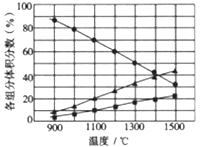
Ⅲ.H2S用作重金屬離子的沉淀劑。
(4)25℃時,向濃度均為0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,當Sn2+開始沉淀時,溶液中c(Ag+)=_______。(已知:25℃時,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com