
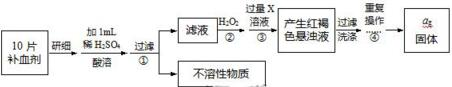
分析 (1)精確配制250mL待測溶液,配制時需要的儀器有天平、藥匙、玻棒、燒杯、膠頭滴管、250mL容量瓶,據此滴定的操作要求可知,滴定時,左手控制滴定管的活塞,右手搖動錐形瓶,眼睛注視錐形瓶內溶液的顏色變化,當看到溶液出現淺紫紅色且保持30s不變時,達滴定終點;
(2)硝酸有強氧化性,可以減小高錳酸鉀的用量,鹽酸具有還原性,增加了高錳酸鉀的用量,硫酸對實驗沒有影響;
(3)亞鐵離子能水解,溶解時要抑制其水解;
(4)Fe2+與堿反應后不能保證Fe2+全部轉化為Fe3+,加熱不能得到純凈的Fe2O3,故無法準確計算Fe的含量;
(5)步驟④中一系列處理是由氫氧化鐵懸濁液最終轉化為氧化鐵,需要過濾、洗滌的氫氧化鐵,然后灼燒生成氧化鐵,冷卻后稱量氧化鐵的質量,為了保證灼燒充分,要使最后得到的固體恒重為止;
(6)根據鐵元素守恒可知ag氧化鐵中鐵元素的質量即為10片補血劑中鐵的質量,據此計算.
解答 解:(1)精確配制250mL待測溶液,配制時需要的玻璃儀器有玻棒、燒杯、膠頭滴管、250mL容量瓶,據此滴定的操作要求可知,滴定時,左手控制滴定管的活塞,右手搖動錐形瓶,眼睛注視錐形瓶內溶液的顏色變化,當看到溶液出現淺紫紅色且保持30s不變時,達滴定終點;
故答案為:玻棒、250mL容量瓶;錐形瓶內溶液的顏色變化;溶液出現淺紫紅色且保持30s不變;
(2)硝酸有強氧化性,可以減小高錳酸鉀的用量,鹽酸具有還原性,增加了高錳酸鉀的用量,硫酸對實驗沒有影響,所以用硝酸酸化會使測定結果偏小,用鹽酸酸化會使測定結果偏大,用硫酸酸化對測定結果無影響,
故答案為:偏小、無影響、偏大;
(3)亞鐵離子能水解,溶解時要抑制其水解,所以加入1ml稀硫酸的目的是防止亞鐵離子水解,
故答案為:防止亞鐵離子水解;
(4)Fe2+與堿反應后不能保證Fe2+全部轉化為Fe3+,加熱不能得到純凈的Fe2O3,故無法準確計算Fe的含量,故步驟②不能省略;
故答案為:不能;Fe2+與堿反應后不能保證Fe2+全部轉化為Fe3+,加熱不能得到純凈的Fe2O3,故無法準確計算Fe的含量;
(5)步驟④中一系列處理是由氫氧化鐵懸濁液最終轉化為氧化鐵,需要過濾、洗滌的氫氧化鐵,然后灼燒生成氧化鐵,冷卻后稱量氧化鐵的質量為了保證灼燒充分,要使最后得到的固體恒重為止,所以重復操作加熱、冷卻、稱量,直到兩次稱量的質量差小于0.1g為止;
故答案為:兩次稱量的質量差小于0.1g;
(6)ag氧化鐵中鐵元素的質量即為10片補血劑中鐵的質量,所以每片補血劑含鐵元素的質量 $\frac{ag×\frac{112}{160}}{10}$=0.07ag,故答案為:0.07a.
點評 本題考查學生對實驗原理與實驗操作的理解、物質分離提純、元素化合物性質、氧化還原反應滴定、化學計算等,難度中等,清楚實驗原理是解題的關鍵,需要學生具備扎實的基礎知識與綜合運用知識分析問題、解決問題的能力.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 分液.
分液.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 紅棕色的NO2氣體加壓后顏色先變深再變淺 | |
| B. | 打開汽水瓶,看到有大量的氣泡逸出 | |
| C. | 二氧化硫轉化為三氧化硫時增加空氣的量以提高二氧化硫的轉化率 | |
| D. | H2、I2、HI混合氣體加壓后顏色變深 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
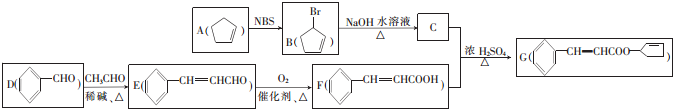
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr,其反應類型為取代反應.
+NaBr,其反應類型為取代反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用如圖2表示:
分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用如圖2表示:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
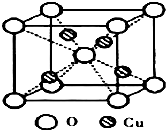 銅是過渡元素.化合物中,銅常呈現+1價或+2價.
銅是過渡元素.化合物中,銅常呈現+1價或+2價. ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com