
【題目】一定溫度下,在固定體積的密閉容器中發生反應:2HI(g)![]() H2(g)+I2(g),0~15s內c(HI)由0.lmol/L降到0.07mol/L,則下列說法正確的是( )
H2(g)+I2(g),0~15s內c(HI)由0.lmol/L降到0.07mol/L,則下列說法正確的是( )
A. 容器中,反應平衡時的壓強大于起始時的壓強
B. c(HI)由0.07mol/L降到0.05mol/L所需的反應時間大于10s
C. 升高溫度正反應速率加快,逆反應速率減慢
D. 0~15s內用I2表示的平均反應速率為:v(I2)=0.002mol/(L·s)
科目:高中化學 來源: 題型:
【題目】熟悉和使用中學化學實驗中常見儀器及用品,是化學學習的基本要求。試回答以下問題:
(1)在儀器:a.分液漏斗 b.試劑瓶 c.集氣瓶 d.滴定管 e.容量瓶 f.量筒 g.托盤天平中,標有“0”刻度的是_____________(填序號)。
(2)蒸發皿的使用:把濾液倒入蒸發皿中,再把蒸發皿放到鐵架臺的鐵圈上。用酒精燈加熱,同時用玻璃棒不斷攪拌,以防止___________。當蒸發皿里的液體較少時,則應____________________,利用余熱,使剩余溶劑揮發。
(3)用裝置甲、乙、丙和乳膠管組成一套裝置(氣密性已檢查),可用于制取并收集NH3或HCl氣體。可供選擇的液體試劑(固體試劑任選)有:濃硫酸、濃鹽酸、濃氨水,丙中試劑為紫色石蕊溶液。請回答下列問題:

①若制取某氣體的過程中,丙中的石蕊溶液變紅,且燒瓶中的試劑A與分液漏斗中的試劑B均為無色液體,則試劑A為____,制取該氣體利用了B的性質有____、___________。
②通過丙中紫色石蕊溶液變紅或變藍,說明乙中氣體已集滿。若石蕊溶液變藍,則燒瓶甲中應加入的固體試劑A為____;若在乙中收集氨氣,氣體流經裝置的順序是a→___→___→d(填接口代號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于生物體內元素的敘述,正確的是( )

A. 各種元素在細胞與非生物界的含量差異不大
B. 細胞內含量最多的元素是C,因此C是生命的核心元素
C. 細胞內含有Fe、Cu、Mn、Zn、B、Mo等作用不重要的微量元素
D. 烘干的植物細胞中含量最多的元素是C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種短周期元素,原子半徑的大小關系為 r(Y)>r(X)>r(Z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生如圖所示變化,其中B和C均為10電子分子。下列說法中正確的是

A. X元素位于第ⅣA族
B. A能溶解于B中
C. A和C不可能發生氧化還原反應
D. B的沸點高于C的沸點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1-36號A、B、C、D、E、F六種元素,其中A、B、C、D、E的原子序數均小于18且其核電荷數依次遞增,B元素基態原子電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,D原子的價電子排布為ns2np2n+2,E原子第一至第四電離能(kJ·mol-1)分別為:738、1451、7733、10540。F2+離子K、L、M層全充滿。根據以上信息,同答下列問題:
(1)BA4D和BA2D,沸點較高的是________(填相關物質的結構簡式)
(2)已知B與A形成的化合物在標準狀況下的密度為1.16g·L-1,則在該化合物分子空間構型_________,在該化合物分子中含有σ鍵和π鍵個數比__________。
(3)寫出單質F與足量C的最高價氧化物對應的水化物稀溶液反應,C被還原到最低價,該反應的化學方程式________________________
(4)B的單質是一種層狀結構,元素B和E的形成一種合金,E的原子位于B的層間,其投影位于層面六圓環的中央,“△”表示E的原子位置,平行四邊形表示在此二維圖形上畫出的一個晶胞,該合金的化學式為_______________________。
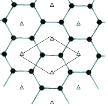
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于物質組成的說法中,正確的是
A.酸、堿、鹽可能都不含金屬元素
B.含氧元素的化合物一定是氧化物
C.單質不一定只含一種元素
D.酸、堿中一定含氫,鹽一定不含氫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙氣脫硫能有效減少二氧化硫的排放,實驗室用粉煤灰(主要含Al2O3、SiO2等)制備堿式硫酸鋁[Al2(SO4)x(OH)6﹣2x]溶液,并用于煙氣脫硫研究。

下列說法錯誤的是
A. 濾渣Ⅰ的主要成分為SiO2
B. 加CaCO3調節溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3轉化為Al2(SO4)x(OH)6﹣2x
C. 調節pH時若溶液的pH偏高,將會導致溶液中鋁元素的含量降低,相應的離子方程式如下:3CaCO3+2Al3++3H2O=2Al(OH)3+3Ca2++3CO2↑
D. 上述流程中經完全熱分解放出的SO2量總是小于吸收的SO2的量,其主要原因是溶液中的部分SO32-被氧化成SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩份等質量Na2O2和NaHCO3均勻混和物,向其中一份加入100mL鹽酸,充分反應呈中性,放出氣體經干燥后測得體積為2.24L(標準狀況)。如將該氣體通入另一混和物中充分反應后,氣體體積變為2.016L(標準狀況)。若混合物中NaHCO3的物質的量大于Na2O2。則:
(1)原混和物中Na2O2與NaHCO3的物質的量之比為__________________;
(2)加入鹽酸的物質的量的濃度為_____________mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取一支硬質大試管,通過排飽和食鹽水的方法先后收集半試管甲烷和半試管氯氣(如圖),下列對于試管內發生的反應及現象的說法正確的是:

A. 為加快化學反應速率,應在強光照射下完成
B. 甲烷和 Cl2 反應后試管內壁的油狀液滴物包括 CH3Cl 、CH2Cl2、CHCl3、CCl4
C. 盛放飽和食鹽水的水槽底部會有少量晶體析出
D. CH4 和 Cl2 完全反應后液面上升,液體充滿試管
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com