
【題目】下圖是某化學興趣小組探究不同條件下化學能轉變為電能的裝置。請根據原電池原理回答問題:
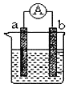
(1)若電極a為Zn、電極b為Cu、電解質溶液為稀硫酸,該裝置工作時,SO42向_____極(填a或b)移動,正極的電極反應式為_______________________________。
(2)若電極a為Mg、電極b為Al、電解質溶液為氫氧化鈉溶液,該原電池工作時,電子從_____極(填a或b)流出。一段時間后,若反應轉移3NA個電子,則理論上消耗Al的質量是________g。
【答案】a 2H++2e-=H2↑ b 27
【解析】
原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應,據此解答。
(1)若電極a為Zn、電極b為Cu、電解質溶液為稀硫酸,由于金屬性Zn>Cu,則鋅是負極,銅是正極,所以該裝置工作時,SO42-向負極即顯a極移動,正極上氫離子放電,電極反應式為2H++2e-=H2↑。
(2)若電極a為Mg、電極b為Al、電解質溶液為氫氧化鈉溶液,由于鋁能與氫氧化鈉溶液反應,則鋁是負極,鎂是正極,因此該原電池工作時,電子從b極流出。1mol鋁在反應中失去3mol電子,一段時間后,若反應轉移3NA個電子,則理論上消耗Al的物質的量是1mol,質量是27g。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】從樟科植物葉中提取的精油成分存在如下轉化關系:
![]()
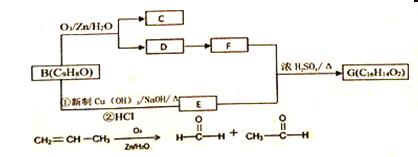
(1)物質由D轉化為F時的反應類型是__________;A中含有的官能團名稱______。
(2)關于甲的說法正確的是________
A.能與金屬鈉反應放出氫氣 B.1mol甲最多能與1molH2發生加成反應
C.甲在一定條件下能形成高分子化合物
(3)B分子中最多有______個碳原子共面
(4)寫出B轉化為E的化學反應方程式①_________________________;②____________________________________。
(5)寫出E+F→G的化學反應方程式_________________________。
(6)寫出符合下列要求的E得同分異構體的結構簡式_____________。
①苯環上只有兩個取代基 ②能使溴的CCl4溶液褪色,且在酸性條件下能發生水解
③核磁共振氫譜顯示吸收峰面積之比1:1:2:2:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Cu與濃硝酸反應中,若有1molHNO3 被還原,則發生轉移的電子是( )
A. 1mol B. 2mol C. 0.5mol D. 0.25mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬釩(V)及其化合物有著廣泛的用途。請回答以下問題:
(1)釩在溶液中的主要聚合狀態與溶液的pH關系如圖1所示。V2O74-中V元素的化合價是_____,請寫出溶液中VO3-轉化為V2O74-的離子方程式:____________。
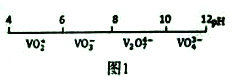
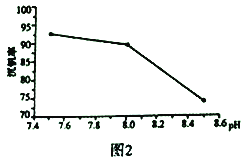
(2)“弱堿性按鹽沉釩法”原理是在含有釩元素的溶液中加入銨鹽后形成NH4VO3沉淀,圖2是在工業生產中不同pH環境下沉釩率的測定值。實際工業生產中常選擇pH=7.5為沉釩的最佳條件,當pH超過8.0時沉釩率降低,其原因是溶液中VO3-轉化為V2O74-、_______。(請另寫出一點原因)
(3)NH4VO3在高溫下分解產生的V2O5可作為硫酸工業中2SO2(g)+O2(g)![]() 2SO3(g) △H=p的催化劑,其催化原理如圖3所示。
2SO3(g) △H=p的催化劑,其催化原理如圖3所示。
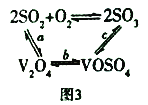
①過程a和過程b的化學方程式為:V2O5(s)+SO2(g)=V2O4(s)+SO3(g)△H=q;
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(g)△H=r
請寫出過程c的熱化學方程式:_________________。
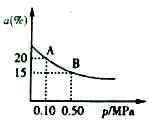
②t2℃下,反應:2SO3(g)![]() 2SO2(g)+O2(g)△H>0;SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖所示。t℃下,將2molSO3置于10L密閉容器中,反應達平衡后,體系總壓強為0.10MPa。B點的化學平衡常數的值是__________。
2SO2(g)+O2(g)△H>0;SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖所示。t℃下,將2molSO3置于10L密閉容器中,反應達平衡后,體系總壓強為0.10MPa。B點的化學平衡常數的值是__________。
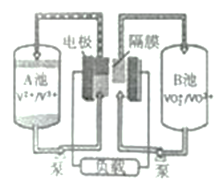
(4)全釩夜流電池是一種可充電電池,裝置如圖所示。若在放電過程中有H+從A池移向B池,則:
①放電過程中,起負極作用的是_______池(填“A”或“B”)。
②充電過程中,陽極方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴螨酯是一種殺螨劑。由某種苯的同系物制備溴螨酯的一種合成路線如下( 部分反應條件和試劑略):
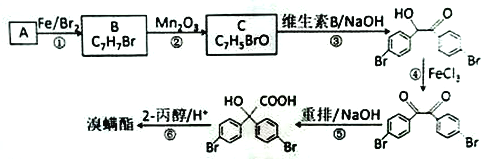
回答下列問題:
(1)A的名稱是________,B 的結構簡式是_______。
(2)C能發生銀鏡反應,其分子中含氧官能團的名稱是_______。
(3)寫出第3 步反應的化學方程式:________。
(4)第①、④步的反應類型分別是_______、_______。
(5)M為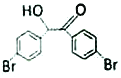 的同分異構體,其核磁共振氫譜顯示有4 種不同化學環境的氫,且數目比為4:4:1:1,M的結構簡式為____________。
的同分異構體,其核磁共振氫譜顯示有4 種不同化學環境的氫,且數目比為4:4:1:1,M的結構簡式為____________。
(6)寫出用乙醛為原料制備2-羥基-2-甲基丙酸乙酯的合成路線( 其它試劑任選):________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”,研究NO2、NO、CO、S02等大氣污染物和水污染物的處理對建設美麗中國具有重要意義。
(1)已知: ①NO2+CO![]() CO2+NO該反應的平衡常數為K1(下同),每1mol下列物質分解為氣態基態原子吸收的能量分別為
CO2+NO該反應的平衡常數為K1(下同),每1mol下列物質分解為氣態基態原子吸收的能量分別為
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
寫出NO與CO反應生成無污染氣體的熱化學方程式____________________________________,該熱化學方程式的平衡常數K=_________(用K1、K2、K3表示)。
(2)在體積可變的恒壓(p總)密閉容器中充入1molCO2 與足量的碳,讓其發生反應: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡時,體系中氣體體積分數與溫度的關系如下圖所示。
2CO(g) △H>0。平衡時,體系中氣體體積分數與溫度的關系如下圖所示。
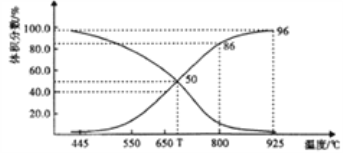
①T℃時,在容器中若充入稀有氣體,v(正)___v(逆)(填“>”“<”或“="),平衡______移動(填“正向”“逆向”或“不”。下同);若充入等體積的CO2 和CO,平衡________移動。
②CO體積分數為40%時,CO2 的轉化率為_______。
③已知:氣體分壓(p分)=氣體總壓×體積分數。用平衡分壓代替平衡濃度表示平衡Kp常數的表達式為__________;925℃時,Kp=______(用含p總的代數式表示)。
(3)直接排放含SO2 的煙氣會形成酸雨,危害環境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反應后的溶液中,它們的物質的量分數X(i)與溶液pH的關系如圖所示。

①若是0.1mol/LNaOH 反應后的溶液,測得溶液的pH=8時,溶液中各離子濃度由大到小的順序是______________。
②向pH=5的NaHSO3溶液中滴加一定濃度的CaCl2 溶液,溶液中出現渾濁,pH降為2,用化學平衡移動原理解釋溶液pH降低的原因_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。催化劑常具有較強的選擇性,即專一性。已知:
反應I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反應 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化學鍵 | H—O | O=O | N≡N | N—H |
鍵能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒溫恒容裝置中充入一定量的NH3和O2,在某催化劑的作用下進行反應I,則下列有關敘述中正確的是__________________。
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B.若測得容器內4v正(NH3)=6v逆(H2O)時,說明反應已達平衡
C.當容器內![]() =1時,說明反應已達平衡
=1時,說明反應已達平衡
(3)氨催化氧化時會發生上述兩個競爭反應I、II。為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1 mol NH3和2mol O2,測得有關物質的量關系如下圖:
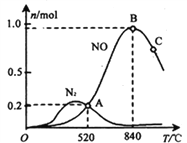
①該催化劑在高溫時選擇反應____________ (填“ I ”或“ II”)。
② 520℃時,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常數K=____________________________ (不要求得出計算結果,只需列出數字計算式)。
4NO(g) +6H2O(g)的平衡常數K=____________________________ (不要求得出計算結果,只需列出數字計算式)。
③有利于提高NH3轉化為N2平衡轉化率的措施有_______________
A.使用催化劑Pt/Ru
B.使用催化劑Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不變,增加反應物的濃度
E.降低反應溫度
(4)采用氨水吸收煙氣中的SO2,
①若氨水與SO2恰好完全反應生成正鹽,則此時溶液呈_____性(填“酸”或“堿”)常溫下弱電解質的電離平衡常數如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______氣體可使溶液呈中性,(填“SO2”或NH3”)此時溶液離子濃度由大到小的順序_________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com