
【題目】室溫下,一定體積pH=12的Ba(OH)2溶液中,逐滴加入一定物質的量濃度的Na2SO4溶液,當溶液中的Ba2+恰好完全沉淀時,溶液的pH=11(忽略反應前后的體積變化),則Ba(OH)2溶液與Na2SO4溶液的體積比是( )
A.1:9B.1:1C.1:2D.1:4
科目:高中化學 來源: 題型:
【題目】電離平衡常數是衡量弱電解質電離程度強弱的量。已知如表數據。
化學式 | 電離平衡常數(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃時,有等濃度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三種溶液的pH由大到小的順序為__________________。
(2)25 ℃時,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液顯酸性,則c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所發生反應的化學方程式為___________。
(4)25 ℃時, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當電解質中某離子的濃度越大時,其氧化性或還原性越強,利用這一性質,有人設計出如如圖所示“濃差電池”(其電動勢取決于物質的濃度差,是由一種物質從高濃度向低濃度轉移而產生的)。其中,甲池為3 mol/L的AgNO3溶液,乙池為1 mol/L的AgNO3溶液A、B均為Ag電極。實驗開始先斷開K1,閉合K2,發現電流計指針發生偏轉。下列說法不正確的是
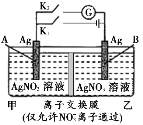
A.斷開K1、閉合K2,一段時間后電流計指針歸零,此時兩池銀離子濃度相等
B.斷開K1、閉合K2,當轉移0.1 mol e-時,乙池溶液質量增加17.0 g
C.當電流計指針歸零后,斷開K2、閉合K1,一段時間后B電極的質量增加
D.當電流計指針歸零后,斷開K2、閉合K1,乙池溶液濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,鐵有δ、γ、α三種同素異形體,三種晶體在不同溫度下能發生轉化。下列說法正確的是 ( )

A. γ-Fe晶體中與每個鐵原子距離相等且最近的鐵原子有6個
B. α-Fe晶體中與每個鐵原子距離相等且最近的鐵原子有6個
C. 將鐵加熱到1 500 ℃分別急速冷卻和緩慢冷卻,得到的晶體類型相同
D. 三種同素異形體的性質相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等。
已知:①CuCl可以由CuCl2用適當的還原劑如SO2,SnCl2等還原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:  。
。
請回答下列問題:
(1)基態Cu原子的核外電子排布式為_____;H、N、O三種元素的電負性由大到小的順序是____。
(2)SO2分子的空間構型為________;與SnCl4互為等電子體的一種離子的化學式為________。
(3)乙二胺分子中氮原子軌道的雜化類型為________。乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高得多,原因是__________。
(4)②中所形成的配離子中含有的化學鍵類型有______(填字母)。
A.配位鍵 B.極性鍵 C.離子鍵 D.非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電化學的實驗事實正確的是( )
出現環境 | 實驗事實 | |
A | 以稀H2SO4為電解質的Cu-Zn原電池 | Cu為正極,正極上發生還原反應 |
B | 電解CuCl2溶液 | 電子經過負極→陰極 |
C | 弱酸性環境下鋼鐵腐蝕 | 負極處產生H2,正極處吸收O2 |
D | 將鋼閘門與外加電源負極相連 | 犧牲陽極陰極保護法,可防止鋼閘門腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉是人體中一種重要元素,一般情況下,鈉約占成人體重的0.15%。鈉元素對應的化合物因組成與結構性質差異很大。
(1)鈉原子核外電子共占據_______個軌道,寫出同一周期中原子核外M層上有2個未成對電子的元素其原子最外層電子排布式_______。
(2)氯化鈉的熔點比氯化鉀的_______(填“高”或“低”),原因是________。
(3)實驗室可用濃氨水與氫氧化鈉固體反應制取氨氣,試用平衡原理分析氫氧化鈉的作用:___。
(4)氟化鈉溶液中,不存在的微粒間作用力是_________(填標號)。
A.離子鍵 B.共價鍵 C.金屬鍵 D.范德華力
(5)卡斯納法制取金屬鈉的原理是:以氫氧化鈉為原料,放入鐵質容器中熔化,在稀有氣體的保護下,以鎳為陽極,鐵為陰極,在陰極析出金屬鈉。寫出反應的化學方程式為:_______。其中,氧化產物是:_____,若反應轉移0.8mol電子,至少消耗______g NaOH。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按照要求回答下列問題
(1)硫酸鐵溶液顯酸性的原因_____(用離子方程式表示).
(2)物質的量濃度相同的醋酸和氫氧化鈉溶液混合溶液中c(CH3COO﹣)=c(Na+),則混合后溶液顯_____性.
(3)濃度均為0.1mol/L①氯化銨②醋酸銨③硫酸氫銨④氨水四種溶液中,c(NH4+)由大到小的順序_____(填序號).
(4)將化合物A的蒸氣1mol充入0.5L容器中加熱分解:2A(g)B(g)+nC(g),反應到3min時,容器內A的濃度為0.8mol/L,測得這段時間內,平均速率ν(C)=0.6mol/(Lmin),則化學方程式中的n值為_____,ν(B)=_____,此時A的分解率為_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氟化氮(NF3)(氟只有兩種價態:-1,0)是微電子工業中優良的等離子刻蝕氣體,它在潮濕的環境中能發生反應:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有關該反應的說法正確的是( )
2NO+HNO3+9HF。下列有關該反應的說法正確的是( )
A. NF3是氧化劑,H2O是還原劑
B. 若1mol NF3被氧化,反應轉移電子數為2NA
C. 若生成0.4molHNO3,則轉移0.4mol電子
D. 氧化劑與還原劑的物質的量之比為1∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com