
【題目】亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌。以下是過氧化氫法生產亞氯酸鈉的工藝流程圖:

已知:①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO23H2O
②純ClO2常溫下為氣體,易分解爆炸,一般用稀有氣體或空氣稀釋到10%以下安全
(1)10%的NaOH溶液的密度為1.2g/cm3其物質的量濃度為__________________________。
(2)在ClO2發生器中當1gSO2完全轉化時,放出akJ熱量,寫出該熱化學反應方程式___________________ ,鼓入Ar的作用是 。
(3)寫出吸收塔內發生的化學反應方程式 _______________________________。吸收塔的溫度不能超過40℃,其目的是________________________________。
(4)從濾液中得到的NaClO23H2O粗晶體中往往含有雜質,要得到更純的NaClO23H2O晶體方法是_________________。
(5)工業處理含NaClO2廢水時,先向廢水中加入適量NaOH,用惰性電極電解該廢水,同時制得NaClO3,
寫出ClO2—在陽極放電時的電極反應方程式 。
(6)已知SO2和Ar的混合氣體中,SO2的百分含量為5.6a%,當bL(標況下)該混合氣體參加反應時,理論上需要的17%的H2O2的質量為____________________ g(結果必須化簡)。
【答案】(1)3mol/L
(2)2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g) ΔH= - 64akJ/mol 稀釋ClO2防止分解爆炸
(3)H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O 防止H2O2分解
(4)重結晶
(5)ClO2- - 2e-+2OH-=ClO3-+H2O
(6)0.5ab
【解析】
試題分析:(1)利用公式:c=計算10%的NaOH溶液的密度為1.2g/cm3其物質的量濃度為(1000×1.2g/cm3×10%)÷40g/mol=3mol/L 。
(2)根據題給化學工藝流程知ClO2發生器中,SO2和NaClO3反應生成ClO2和硫酸鈉,當1gSO2完全轉化時,放出akJ熱量,該熱化學反應方程式為2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g) ΔH= - 64akJ/mol ,根據信息②純ClO2常溫下為氣體,易分解爆炸,一般用稀有氣體或空氣稀釋到10%以下安全知鼓入Ar的作用是稀釋ClO2防止分解爆炸。
(3)根據題給信息知吸收塔內ClO2被還原為NaClO2,則H2O2被氧化生成氧氣,利用化合價升降法配平,發生的化學反應方程式為H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O;過氧化氫受熱易分解,則吸收塔的溫度不能超過40℃,其目的是防止H2O2分解。
(4)從濾液中得到的NaClO23H2O粗晶體中往往含有氫氧化鈉等可溶性雜質,要得到更純的NaClO23H2O晶體方法是重結晶。
(5)根據題意知惰性電極電解該廢水,陽極上ClO2—轉化為ClO3-,氯元素的化合價由+3價升高到+5價,失去兩個電子,溶液呈堿性,利用氫氧根和水配平,電極反應式為ClO2- - 2e-+2OH-=ClO3-+H2O。
(6)根據反應:2NaClO3+SO2=Na2SO4+2ClO2、H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O得關系式為SO2——H2O2,bL(標況下)混合氣體中SO2的物質的量為(5.6a%×bL)÷22.4L/mol=0.0025abmol,則參加的H2O2的物質的量為0.0025abmol,質量為0.0025abmol×34g/mol,理論上需要的17%的H2O2的質量為(0.0025abmol×34g/mol)÷17%=0.5abg。


科目:高中化學 來源: 題型:
【題目】(1)反應3A(g)+B(g) ===2C(g)在三種不同的條件下進行反應,在同一時間內,測得的反應速率用不同的物質表示為①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三種情況下該反應速率由大到小的關系是 。(用序號表示)
(2)某溫度時,在一個5L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示。根據圖中數據填空:

①該反應的化學方程式為____________________________。
②反應開始至2min,以氣體Z表示的平均反應速率為 。
③2min反應達平衡容器內混合氣體的平均相對分子質量比起 始時 (填“大”,“小”或“相等”下同),混合氣體密度比起始時 。
④上述反應,在第2min時,X的轉化率為 。
⑤將a mol X與b mol Y的混合氣體發生上述反應,反應到某時刻各物質的量恰好滿足:n (X) = n (Y) = n (Z),則原混合氣體中a : b =__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉可大量用于染料和有機合成工業。請回答下列問題:
(1)亞硝酸鈉能氧化酸性條件下的Fe2+,同時產生一種活性氣體,該氣體在空氣中迅速變色。寫出反應的離子方程式 。
(2)實驗室模擬用如圖所示裝置通過如下過程制備亞硝酸鈉:


已知:(I)氧化過程中,控制反應液的溫度在35~60℃條件下發生的主要反應:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氫氧化鈉溶液吸收NO、NO2發生如下反應:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反應溫度不宜高于60℃,原因是 。
②不經過任何處理,按此過程進行,氫氧化鈉溶液吸收后的溶液中除OH外還有兩種陰離子,其中一種是NO2,NO2與另一種陰離子的物質的量之比為 。
③B裝置用于制備NaNO2,盛裝的試劑除NaOH外,還可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)測定產品純度:
I.準確稱量ag產品配成100 mL溶液;
II.從步驟I配制的溶液中移取20.00 mL加入錐形瓶中;
III.用c mol·L1酸性KMnO4溶液滴定至終點;
IV.重復以上操作3次,消耗KMnO4酸性溶液的平均體積為V mL。
①錐形瓶中發生反應的離子方程式為 。
②滴定至終點的現象為 。
③產品中NaNO2的純度為 (寫出計算表達式)。
④若滴定終點時俯視讀數,則測得的產品中NaNO2的純度 (填“偏高”、“偏低”或“無影響”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解精煉銅的陽極泥中含有多種貴重金屬,從中提取金、銀、鉑的一種工藝如下:
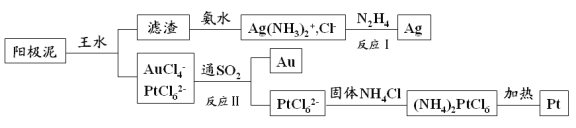
(1)王水是 的混合液,其體積比為 。
(2)濾渣的成分是 ,反應Ⅰ中肼(N2H4)的作用是 。
(3)反應Ⅱ的離子方程式為 ;當生成19.7gAu時,25℃和101kPa下反應消耗 L SO2(此條件下的氣體摩爾體積為24.5L/mol,相對原子質量Au:197)。
(4)電解法精煉銀時,粗銀應與直流電源的 極(填“正”或“負”)相連,當用AgNO 3 和HNO 3 混合溶液做電解質溶液時,發現陰極有少量紅棕色氣體,則產生該現象的電極反應式為 。
(5)金和濃硝酸反應的化學方程式為:Au+6HNO3(濃)=Au(NO3)3+3NO2↑+3H2O,但該反應的平衡常數很小,所以金和濃硝酸幾乎不反應,但金卻可以溶于王水,原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上,向500-600℃的鐵屑中通入氯氣生產無水氯化鐵;向熾熱鐵屑中通入氯化氫生產無水氯化亞鐵。現用如圖所示的裝置模擬上述過程進行實驗。

回答下列問題:
(1)制取無水氯化鐵的實驗中,A中反應的化學方程式為 ,當生成1molCl2時,轉移的電子數為 ,玻璃絲的作用是 ,裝置B中加入的試劑是 。裝置D中加入的試劑是 。
(2)制取無水氯化亞鐵的實驗中,尾氣的成分是 。若仍用D的裝置進行尾氣處理,存在的問題是 、 。
(3)若操作不當,制得的FeCl2會含有少量FeCl3雜質,下列說法中正確的是
A.檢驗FeCl3常用的試劑是KSCN溶液
B.可向固體混合物中加入適量Fe粉除去雜質
C.可向固體混合物中通入適量Cl2除去雜質
D.欲制得純凈的FeCl2,在實驗操作中應先點燃A處的酒精燈,在點燃C處的酒精燈。
(4)現有一包FeCl2和FeCl3混合物,某化學興趣小組為測定各成分的含量進行如下兩個實驗:
實驗1:①稱取一定質量的樣品,將樣品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,產生沉淀;③將沉淀過濾、洗滌、干燥得到白色固體28.7g。
實驗2:①稱取與實驗1中相同質量的樣品,溶解;②加入足量的NaOH溶液,③將沉淀過濾、洗滌后,加熱灼燒到質量不再減少,得到固體6.4g。則樣品中FeCl3的物質的量為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化合物6.4g在氧氣中完全燃燒,只生成8.8gCO2和7.2gH2O。下列說法正確的是
A.該化合物僅含碳、氫兩種元素
B.該化合物中碳、氫原子個數比為1:4
C.無法確定該化合物是否含有氧元素
D.該化合物一定是C2H8O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣在氯氣中燃燒產生蒼白色火焰。在反應過程中,破壞1 mol 氫氣中的化學鍵消耗的能量為Q1kJ,破壞1 mol 氯氣中的化學鍵消耗的能量為Q2KJ,形成1 mol 氯化氫中的化學鍵釋放的能量為Q3kJ。下列關系式中正確的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 >2Q3 C.Q1 + Q2 <Q3 D.Q1 + Q2 <2Q3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由于金屬鋅本身的價值不高,在我國工業鋅廢料的回收利用率比較低。某課題組研究利用含少量銅、鐵的粗鋅制備硫酸鋅及相關物質的資源綜合利用,其工藝流程圖(圖中加入的物質均為足量)及有關數據如下:

物質 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
Ksp | 4.0×10—38 | 5.0×10—20 | 2.0×10—16 | 8.5×10—45 | 1.2×10—23 |
請回答下列問題:
(1)固體A的主要成分是 ;加入固體B的主要作用是 。
(2)粗鋅中的銅與稀混酸溶液反應的離子方程式為 。
(3)若溶液II中c(Cu2+)為0.05mol·L—1,則溶液II的pH≤ 。
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol·L—1稀硝酸中,共收集到2240mL氣體,再向所得溶液中加入NaOH溶液至剛好生成沉淀最多,此時所得沉淀質量(m)的取值范圍是 ;若B是另一種物質,取部分C于試管中,加入鹽酸后產生了有臭雞蛋味氣體,則該反應的離子方程式為 。
(5)溶液III還可以與(NH4)2S溶液反應制備ZnS,實際生產中選用(NH4)2S溶液而不是Na2S溶液作為反應物,是因為后者制得的ZnS中會含有較多的 雜質。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一份含有FeCl3和FeCl2固體的混合物,為測定FeCl2的含量,進行如下實驗:
①稱取混合物樣品的質量7.06g,將樣品溶解
②向溶解后的溶液中,加入足量的雙氧水
③再向②所得溶液中加入足量的NaOH溶液,得到紅褐色沉淀
④將沉淀過濾、洗滌后,加熱灼燒,到質量不再減少,得到固體物質4.00g
根據實驗回答下列問題:
(1)樣品溶解過程中需加入___________,以防止__________________;
(2)寫出溶解后的溶液與雙氧水反應的離子方程式____________;
(3)過濾操作中除用漏斗外,還需要的玻璃儀器有____________;
(4)簡述檢驗實驗步驟④中沉淀已經洗滌干凈的方法____________;
(5)通過實驗所得數據,計算固體樣品中FeCl2的質量分數:____________;
(6)實驗室采用下列裝置制取少量無水FeCl3固體。(已知FeCl3固體易潮解,部分夾持儀器已略去。)

該裝置存在明顯缺陷,得不到無水FeCl3固體,請你對該裝置進行合理的改進:____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com