
【題目】(1)下列物質: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,屬于非電解質的是____________(填序號),屬于強電解質的是_______(填序號)。
(2)寫出NaHCO3水解的離子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常溫下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,應調整溶液的pH,使之大于_______。
(4)現有25℃、pH=1的H2SO4溶液,該溶液的物質的量濃度為______,溶液中由水電離出的c(OH-)=_____。
(5)電解飽和食鹽水溶液時,電極上生成了氣體A 和B,氣體B是____(填化學式);從陰極析出1.42L氣體A,從陽極析出________L氣體B(在標準狀況下)。

【答案】 ② ④⑦ HCO3-+H2O![]() H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
【解析】(1)本題考查強弱電解質、電解質和非電解質,非電解質:在水溶液或熔融狀態都不能導電的化合物,屬于非電解質的是②,強電解質包括強酸、強堿、多數的鹽,因此屬于強電解質的是④⑦;(2)考查水解方程式的書寫,HCO3-屬于弱酸根,發生水解,其水解方程式為HCO3-+H2O ![]() H2CO3+OH-;(3)本題考查溶度積的計算,根據Ksp=c(Cu2+)×c2(OH-),求出此時c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即當pH=4時,此時的溶液為飽和氫氧化銅溶液,即當pH>4時,出現沉淀;(4)本題考查水的離子積的計算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的離子積適合于稀溶液,即硫酸中水電離的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查電解原理,以及電解的計算,根據電解原理,陽極上Cl-先放電,陽極反應式為2Cl--2e-=Cl2↑,氣體B為Cl2,陰極反應式為2H++2e-=H2↑,因此建立關系式為H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。
H2CO3+OH-;(3)本題考查溶度積的計算,根據Ksp=c(Cu2+)×c2(OH-),求出此時c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即當pH=4時,此時的溶液為飽和氫氧化銅溶液,即當pH>4時,出現沉淀;(4)本題考查水的離子積的計算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的離子積適合于稀溶液,即硫酸中水電離的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查電解原理,以及電解的計算,根據電解原理,陽極上Cl-先放電,陽極反應式為2Cl--2e-=Cl2↑,氣體B為Cl2,陰極反應式為2H++2e-=H2↑,因此建立關系式為H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】有下列儀器:鐵架臺、鐵圈、鐵夾、三腳架、石棉網、燒杯、普通漏斗、冷凝管、酒精燈、玻璃棒、量筒、蒸發皿、蒸餾燒瓶、牛角管、錐形瓶、溫度計、坩堝鉗、火柴、濾紙,從缺少必要的儀器和用品的角度考慮,不能進行的分離操作是( )
A.蒸發B.蒸餾C.過濾D.萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的分離和提純的方法中正確的是( )
A.除去Cl2的HCl氣體可以通過濃硫酸
B.碳酸鈉固體中的碳酸氫鈉雜質可以通過加熱除去
C.SO2可以通過堿石灰干燥
D.FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂、硫、氮的化合物在工業上用途非常廣泛。
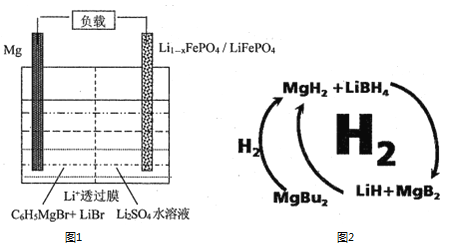
(1)一種鎂—鋰雙離子二次電池的裝置如圖1所示。
①放電時,Mg電極為_____(填“正極”或“負極”)。
②充電時,Li+遷移至_____________(填“陽極區”或“陰極區”)。
(2)納米MgH2和LiBH4組成的體系如圖2所示,400℃以上受熱放氫時發生反應的化學方程式為_____________________________________________。
(3)硝酸廠尾氣中含有大量的NO,可用氫氣催化還原法除去NO,發生的主要反應如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
則2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定條件下,反應:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡時CH4的轉化率與溫度和壓強的關系如圖3所示。
2CO(g)+2H2(g)平衡時CH4的轉化率與溫度和壓強的關系如圖3所示。
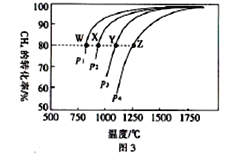
①圖中p1、p2、p3、p4代表不同壓強,壓強最大的是_______。該反應的△H___(填“>”“<”“=”下同)0。
②壓強為p4時,在Y點:v(正)__________v(逆)。
③圖中W、X、Y、Z四點對應的反應的平衡常數K1、K2、K3、K4由大到小的順序為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1。現在一容積為2L的密閉容器中充入2molSO2、1molO2,加入固體催化劑,保持溫度在450℃使之發生反應,5min時達到平衡,測得平衡時體系的壓強減小了30%。下列說法正確的是
2SO3(g) △H=-196kJ·mol-1。現在一容積為2L的密閉容器中充入2molSO2、1molO2,加入固體催化劑,保持溫度在450℃使之發生反應,5min時達到平衡,測得平衡時體系的壓強減小了30%。下列說法正確的是
A. SO2的轉化率為30%
B. 反應共放出了196.6kJ的熱量
C. 用SO2表示的5min內的平均反應速率為0.36mol·L-1·min-1
D. 平衡時SO3的濃度是0.9mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中正確的是( )
A.用25 mL量筒量取4.0 mol/L的鹽酸5.62 mL
B.做蒸餾操作時,冷凝水方向是下進上出
C.用溶解、過濾、蒸發的方法分離氯化鈉與硝酸鉀的混合物
D.用蒸發皿灼燒膽礬(CuSO45H2O)得到CuSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的Fe、Fe3O4、Fe2O3、FeO的混合物中加入200 mL 1 mol·L-1的鹽酸,恰好使混合物完全反應溶解,放出4.48 mL(標準狀況)氣體。所得溶液中,加入KSCN溶液無紅色出現,那么用足量的CO在高溫下還原相同質量的此混合物,得到鐵的質量為
A. 11.2 g B. 5.6 g C. 2.8 g D. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“一帶一路”為中國化工企業開辟了新的國際市場,其中,能源、資源整合和環境治理是保駕護航的基礎。
I:利用太陽能促進燃料循環使用的原理如圖所示,其中過程ⅰ的主要反應如下:

①2CO2(g)![]() 2CO(g)+O2(g) △H1
2CO(g)+O2(g) △H1
②2CO2(g)+4H2O(1) ![]() 2CH3OH(l)+3O2(g)
2CH3OH(l)+3O2(g)
③2H2O![]() 2H2+O2
2H2+O2
④___N2+____![]() NH3+____
NH3+____
⑤CO2+2H2O![]() CH4+2O2
CH4+2O2
(1)反應①的△H______0(填“<”、“>”或“=”)。
(2)下列對過程i、ⅱ的描述中正確的是______。
a.過程i、ⅱ中能量轉化形式是:太陽能→化學能→熱能
b.經過上述一個循環后不會產生新物質
c.經過上述一個循環后放出O2
(3)將反應④補充完整___N2+____![]() NH3+____
NH3+____
Ⅱ:SO2和NOx是主要大氣污染物,利用下圖裝置可同時吸收SO2和NO。

(4)①a是直流電源的_______極。
②已知電解池的陰極室中溶液的pH在4~7之間,陰極的電極反應為:__________。
③用離子方程式表示吸收NO的原理____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列各組物質按酸、堿、鹽分類依次排列,正確的是( )
A.硫酸、純堿、小蘇打
B.磷酸、熟石灰、苛性鈉
C.硫酸氫鈉、生石灰、醋酸鈉
D.硫酸、燒堿、膽礬
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com