
硝酸與金屬反應是硝酸的重要化學性質之一,請閱讀下文并解答有關問題。
(1)ag銅與bmL濃HNO3充分反應后得到V1 L紅棕色氣體X,且溶液中余下cg銅;再將此紅棕色氣體通過水變成V2 L無色氣體Y(氣體已轉換成標準狀況下的體積,設題中產生的氮的化合物分子中均含有一個氮原子。)
①當反應生成X氣體時有多少克氮元素被還原?
②計算X氣體中各組分的物質的量。
(2)若在(1)反應余下的溶液中加入過量的稀H2SO4使留下的cg銅恰好完全溶解;此時溶液中只留下一種鹽。
①寫出此時發生的化學反應方程式
②計算a與c的質量比及濃HNO3的物質的量濃度
① ,②NO2: (3V1-3V2)/44.8
NO: (3V2-V1)/44.8(各2分)
,②NO2: (3V1-3V2)/44.8
NO: (3V2-V1)/44.8(各2分)
(2) ① 3Cu+Cu(NO3)2+4H2SO4 ==4CuSO4+2NO↑+4H2O;
② 4:3; 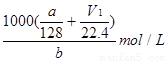
【解析】
試題分析:解:濃硝酸與銅反應生產了二氧化氮和硝酸銅和水,硝酸中氮元素被還原為二氧化氮和一氧化氮,所以生成X氣體時被還原的氮元素的克數為:
②由題可以知道,銅剩余,所以在反應過程中硝酸的濃度越來越稀,所以反應的產物為二氧化氮和一氧化氮的混合物,設二氧化氮的體積為a,則一氧化氮為V1 –a,
而二氧化氮與水的反應為:
3NO2+H2O=2HNO3+NO
3 1
a b
3/1=a/b,b=1/3a,所以V1 –a+1/3a=V2 ,故a= (3V1-3V2)/2,
即NO2的物質的量為:(3V1-3V2)/44.8mol
NO的物質的量為:(3V2-V1)/44.8mol
(2) ① 該反應為:3Cu+Cu(NO3)2+4H2SO4 ==4CuSO4+2NO↑+4H2O;
②因為溶液中只剩下一種鹽,硝酸銅恰好與銅完全反應,
故原來的a:c=(3+1):3=4:3;
硝酸跟的物質的量n=a/128
根據物料守恒可以知道硝酸的物質的量為N元素的物質的量,
故硝酸的物質的量n=(3V1-3V2)/44.8+(3V2-V1)/44.8+a/128=(V1/22.4+a/128)mol;
所以濃硝酸的濃度c=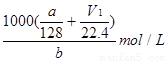 。
。
考點:硝酸與金屬反應
點評:本題考查了硝酸與金屬的反應的計算,該計算題有一定的技巧性,難度比較大。


科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
硝酸與金屬反應是硝酸的重要化學性質之一,請閱讀下文并解答有關問題。
(1)ag銅與bmL濃HNO3充分反應后得到V1 L紅棕色氣體X,且溶液中余下cg銅;再將此紅棕色氣體通過水變成V2 L無色氣體Y(氣體已轉換成標準狀況下的體積,設題中產生的氮的化合物分子中均含有一個氮原子。)
①當反應生成X氣體時有多少克氮元素被還原?
②計算X氣體中各組分的物質的量。
(2)若在(1)反應余下的溶液中加入過量的稀H2SO4使留下的cg銅恰好完全溶解;此時溶液中只留下一種鹽。
①寫出此時發生的化學反應方程式
②計算a與c的質量比及濃HNO3的物質的量濃度
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省江都市甘棠中學高二下學期期末考試化學試卷(帶解析) 題型:計算題
硝酸與金屬反應是硝酸的重要化學性質之一,請閱讀下文并解答有關問題。
(1)ag銅與bmL濃HNO3充分反應后得到V1 L紅棕色氣體X,且溶液中余下cg銅;再將此紅棕色氣體通過水變成V2 L無色氣體Y(氣體已轉換成標準狀況下的體積,設題中產生的氮的化合物分子中均含有一個氮原子。)
①當反應生成X氣體時有多少克氮元素被還原?
②計算X氣體中各組分的物質的量。
(2)若在(1)反應余下的溶液中加入過量的稀H2SO4使留下的cg銅恰好完全溶解;此時溶液中只留下一種鹽。
①寫出此時發生的化學反應方程式
②計算a與c的質量比及濃HNO3的物質的量濃度
查看答案和解析>>
科目:高中化學 來源:2010—2011學年浙江省杭州二中高一下學期期中考試化學試卷 題型:計算題
硝酸與金屬反應是硝酸的重要化學性質之一,請閱讀下文并解答有關問題。
(1)ag銅與bmL濃HNO3充分反應后得到V1 L紅棕色氣體X,且溶液中余下cg銅;再將此紅棕色氣體通過水變成V2 L無色氣體Y(氣體已轉換成標準狀況下的體積,設題中產生的氮的化合物分子中均含有一個氮原子。)
①當反應生成X氣體時有多少克氮元素被還原?
②計算X氣體中各組分的物質的量。
(2)若在(1)反應余下的溶液中加入過量的稀H2SO4使留下的cg銅恰好完全溶解;此時溶液中只留下一種鹽。
①寫出此時發生的化學反應方程式
②計算a與c的質量比及濃HNO3的物質的量濃度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com