
常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.遇苯酚變紫色的溶液:Na+、Mg2+、SO42-、Cl-
B.使甲基橙變紅色的溶液:NH4+、Cu2+、ClO-、Cl-
C.0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3-
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2016屆陜西省高三上期末化學試卷(解析版) 題型:填空題
鐵及其化合物有重要用途,如聚合硫酸鐵[]是一種新型高效的水處理混凝劑,而高鐵酸鉀(其中鐵的化合價為+6)是一種重要的殺菌消毒劑,某課題小組設計如下方案制備上述兩種產品:
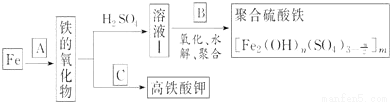
請回答下列問題:
(1)若A為H2O(g),寫出反應方程式___________________________;
(2)若B為NaClO3與稀硫酸,寫出其氧化Fe2+的離子方程式(還原產物為Cl-)_________________;
(3)若C為KNO3和KOH的混合物,寫出其與Fe2O3加熱共融制得高鐵酸鉀(K2FeO4)的化學方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)為測定溶液Ⅰ中鐵元素的總含量,實驗操作如下:準確量取20.00mL溶液Ⅰ于帶塞錐形瓶中,加入足量H2O2,調節pH<3,加熱除去過量H2O2;加入過量KI充分反應后,再用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗標準溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 ; I2+2S2O32-═2I-+S4O42-
①滴定選用的指示劑及滴定終點觀察到的現象__________________________;
②溶液Ⅰ中鐵元素的總含量為__________ g?L-1.若滴定前溶液中H2O2沒有除盡,所測定的鐵元素的含量將會________(填“偏高”“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三上第四次摸底考試化學試卷(解析版) 題型:選擇題
向Na2CO3、NaHCO3混合溶液中逐滴加入稀鹽酸,生成氣體的量隨鹽酸加入量的變化關系如右圖所示。則下列離子組在對應的溶液中,一定能大量共存的是
A.a點對應的溶液中:Na+、OH-、SO42 -、NO3-
B.b點對應的溶液中:Al3+、Fe3+,MnO4- 、Cl-
C.c點對應的溶液中:Na+、Ca2+、NO3- 、Cl-
D.d點對應的溶液中:F-、NO3- 、Fe2+、Ag+
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期第二次質檢化學試卷(解析版) 題型:填空題
氨氣在生產、生活和科研中應用十分廣泛 。
(1)傳統工業上利用氨氣合成尿素
①以CO2與NH3為原料合成尿素的主要反應如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反應2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以發生電離:2NH3(l) NH2-+NH4+,COCl2和液氨發生“復分解”反應生成尿素,寫出該反應的化學方程式______________。
NH2-+NH4+,COCl2和液氨發生“復分解”反應生成尿素,寫出該反應的化學方程式______________。
(2)氨氣易液化,便于儲運,可利用NH3作儲氫材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨氣自發分解的反應條件是________________(填“低溫” 或 “高溫”)。
②其他條件相同,該反應在不同催化劑作用下反應,相同時間后,氨氣的轉化率隨反應溫度 的變化如圖所示。
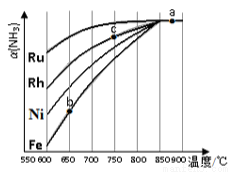
在600℃時催化效果最好的是________________(填催化劑的化學式)。c點氨氣的轉化率高于b點, 原因是________________。
(3)垃圾滲濾液中含有大量的氨氮物質(用NH3表示)和氯化物,把垃圾滲濾液加入到如圖所示的電解池(電極為惰性材料)進行電解除去NH3,凈化污水。該凈化過程分兩步:第一步電解產生氧化劑,第二步氧化劑氧化氨氮物質生成N2。
①寫出電解時A極的電極反應式:________________。
②寫出第二步反應的化學方程式:__________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省滕州市高一上學期12月月考化學試卷(解析版) 題型:實驗題
某化學興趣小組為探究SO2的性質,按下圖所示裝置進行實驗。
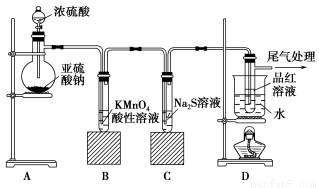
請回答下列問題:
(1)裝置A中盛放亞硫酸鈉的儀器名稱是________,其中發生反應的化學方程式為________________
(2)實驗過程中,裝置B、C中發生的現象分別是________________、________________,這些現象分別說明SO2具有的性質是____________和____________;
(3)裝置D的目的是探究SO2與品紅作用的可逆性,請寫出實驗操作及現象_________________
(4)尾氣可采用__________溶液吸收。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省邵陽市高一上學期第三次月考化學試卷(解析版) 題型:選擇題
有200 mL氯化鎂和氯化鋁的混合溶液,其中c(Mg2+)為0.2 mol·L-1,c(Cl-)為1.3 mol·L-1。要使Mg2+全部轉化為沉淀分離出來,至少需加4 mol·L-1 NaOH溶液的體積為
A.40 mL B.72 mL C.80 mL D.128 mL
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省高一上學期期末考試化學試卷(解析版) 題型:實驗題
掌握儀器的名稱、組裝及使用方法是中學化學實驗的基礎,根據下圖實驗裝置回答問題
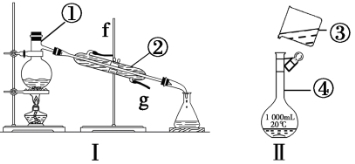
(1)寫出下列儀器的名稱:① ,② ,④ 。
(2)儀器①~④中,使用時必須檢查是否漏水的是 (填序號)。
(3)若利用裝置Ⅰ分離酒精和水的混合物,還缺少的儀器 ,將儀器補充完整后進行的實驗操作的名稱為 ;②的進水口是 (填“f”或“g”)。
(4)現需配制250 mL、0.2 mol·L-1NaCl溶液,裝置Ⅱ是某同學轉移溶液的示意圖,指出圖中的錯誤之處:① ;② 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西省高二上診斷檢測化學試卷(解析版) 題型:選擇題
在25℃時,AgCl的白色懸濁液中,依次加入等濃度的KI溶液和Na2S溶液,觀察到的現象是先出現黃色沉淀,最終出現黑色沉淀。已知有關物質的溶度積Ksp(25℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列敘述錯誤的是( )
A.沉淀轉化的實質就是沉淀溶解平衡的移動
B.溶解度小的沉淀可以轉化為溶解度更小的沉淀
C.AgCl固體在等物質的量濃度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃時,在飽和AgCl、AgI、Ag2S溶液中,所含Ag+的濃度不同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com