D
H
2S燃燒的化學方程式:
2H
2S+O
2(不足)

2S↓+2H
2O ①
當O
2過量時,繼續發生化學反應
S+O
2 
SO
2 ②
合并得
2H
2S+3O
2 ![]()
2SO
2+2H
2O③
則當V(H
2S)∶V(O
2)≥2∶1時,只按①式進行。
當V(H
2S)∶V(O
2)≤2∶3時,只按③式進行。
當2∶3<V(H
2S)∶V(O
2)<2∶1時,可按①式和②式進行(如按①式和③式進行)。
解法一:2H
2S+O
2 
2S↓+2H
2O①
2H
2S+3O
2 ![]()
2SO
2+2H
2O②
從①式考慮:2H
2S ~ O
2 ~ 2S
24mL 30mL
可知余O
2為:30mL-12mL=18mL
余O
2會繼續與S反應生成SO
2,由此可確定生成SO
2的體積:
O
2 ~ SO
2 18mL 18mL
答案為D。
從②式考慮:2H
2S ~ 3O
2 ~ 2SO
2 20mL 30mL 20mL
余H
2S的體積:24mL-20mL=4mL
因2H
2S+SO
2![]()
2H
2O+3S↓
4mLH
2S將消耗2mLSO
2,剩余SO
2為20mL-2mL=18mL。
解法二:H
2S在O
2中燃燒,按H
2S與O
2的體積比(或物質的量之比)不同,可發生不同的反應。
當V(H
2S)∶V(O
2)≥2∶1時:只發生2H
2S+O
2
2S↓+2H
2O
當V(H
2S)∶V(O
2)≤2∶3時:只發生2H
2S+3O
2
2SO
2+2H
2O
現V(H
2S)∶V(O
2)=24∶30=4∶5,介于2∶1~2∶3之間,所以兩個反應均發生。
設不完全燃燒H
2S的體積為x,完全燃燒H
2S的體積為y,則
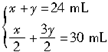
解得
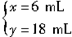
由化學方程式知:生成SO
2的體積等于完全燃燒的H
2S的體積,即為18mL。
解法三:本題H
2S與O
2的體積之比為2∶1>V(H
2S)∶V(O
2)>2∶3,說明兩種燃燒方式均存在,可根據題給H
2S與O
2的體積(或物質的量)之比寫出總的反應方程式:
xH
2S+yO
2 ![]()
xH
2O+
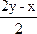
SO
2+
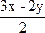
S
將x=24mL、y=30mL代入
![]()
,
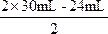
=18mL。

 2S↓+2H2O ①
2S↓+2H2O ① SO2 ②
SO2 ② 2S↓+2H2O①
2S↓+2H2O① 2S↓+2H2O
2S↓+2H2O 2SO2+2H2O
2SO2+2H2O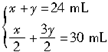 解得
解得 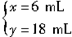
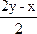 SO2+
SO2+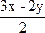 S
S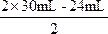 =18mL。
=18mL。 
