
【題目】Na2S可用于制造硫化染料、沉淀水體中的重金屬等。
(1)Na2S溶液中S2-水解的離子方程式為_________。
(2)室溫時,幾種重金屬離子的硫化物的溶度積常數(shù)如下表:
金屬硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物質(zhì)的量濃度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的離子是____。
②用Na2S溶液沉淀廢水中Pb2+,為使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],則應滿足溶液中c(S2-)≥_____mol/L。
③反應Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常數(shù)K=_______。
Fe2+(aq)+CuS(s)的平衡常數(shù)K=_______。
(3)測定某Na2S和NaHS混合樣品中兩者含量的實驗步驟如下:
步驟1.準確稱取一定量樣品于燒杯中,加入少量蒸餾水溶解,轉移至500mL容量瓶中定容。
步驟2.準確移取25.00mL上述溶液于錐形瓶中,加入茜素黃GG-百時香酚藍混合指示劑,用0.2500mol/L鹽酸標準溶液滴定(Na2S+HCl=NaHS+NaCl)至終點,消耗鹽酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示劑,繼續(xù)用0.2500mol/L鹽酸標準溶液滴定(NaOH+HCl=NaCl+H2O)至終點,又消耗鹽酸34.00mL。
計算原混合物中Na2S與NaHS的物質(zhì)的量之比(寫出計算過程)___________。
【答案】S2-+H2O![]() HS-+OH- Hg2+ 1.0×10-22 1.0×1018 n(Na2S)=0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,n(NaHS)=0.2500mol/L×(34.00-24.00)×10-3L/mL=2.500×10-3mol,
HS-+OH- Hg2+ 1.0×10-22 1.0×1018 n(Na2S)=0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,n(NaHS)=0.2500mol/L×(34.00-24.00)×10-3L/mL=2.500×10-3mol,
n(Na2S)∶n(NaHS)=6.000×10-3mol∶2.500×10-3mol=12∶5
【解析】
(1)Na2S是強堿弱酸鹽,由于H2S是二元弱酸,所以在溶液中S2-水解是分步進行的;
(2)①難溶性的物質(zhì)構型相同時,溶度積常數(shù)越小,先形成其沉淀;
②溶液中c(Pb2+)·c(S2-)≥Ksp(PbS)時就形成PbS沉淀;
③根據(jù)平衡常數(shù)的定義式,將其變性,并與溶度積常數(shù)結合起來進行計算;
(3)根據(jù)Na2S+HCl=NaHS+NaCl計算n(Na2S);根據(jù)NaHS+HCHO+H2O→NaOH+HSCH2OH和NaOH+HCl=NaCl+H2O可知n(Na2S)與n(NaHS)的和,兩者相減可得n(NaHS)的物質(zhì)的量,進而可得兩者物質(zhì)的物質(zhì)的量之比。
(1)Na2S是強堿弱酸鹽,由于H2S是二元弱酸,所以在溶液中S2-水解是分步進行的,首先是S2-水解產(chǎn)生HS-,然后是水解產(chǎn)生的HS-進一步水解產(chǎn)生H2S,主要發(fā)生第一步水解反應,水解的離子方程式為:S2-+H2O![]() HS-+OH-;
HS-+OH-;
(2)①Fe2+、Pb2+、Cu2+、Hg2+都是+2價的金屬陽離子,由于它們的濃度相同,因此向該溶液中加入Na2S溶液時,溶度積常數(shù)越小,形成沉淀越容易。根據(jù)重金屬離子的硫化物的溶度積常數(shù)表可知HgS的最小,因此首先形成的是HgS沉淀;
②用Na2S溶液沉淀廢水中Pb2+,使Pb2+沉淀完全,這時溶液中c(Pb2+)≤1×10-6mol/L,由于當c(Pb2+)·c(S2-)≥Ksp(PbS)時就可以形成PbS沉淀,所以c(S2-)≥1.0×10-28÷1.0×10-6=1.0×10-22mol/L;
③反應Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常數(shù)K=
Fe2+(aq)+CuS(s)的平衡常數(shù)K=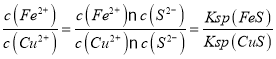 =1.0×1018;
=1.0×1018;
(3)根據(jù)發(fā)生反應Na2S+HCl=NaHS+NaCl消耗HCl可知:在25mL溶液中含有Na2S的物質(zhì)的量為n(Na2S)= 0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,再根據(jù)NaHS+HCHO+H2O→NaOH+HSCH2OH及NaOH+HCl=NaCl+H2O反應消耗的HCl的體積可知25mL溶液中n(Na2S)與n(NaHS)的和為0.2500mol/L×34.00mL×10-3L/mL=8.500×10-3mol,則該溶液中含有NaHS的物質(zhì)的量為n(NaHS)= 8.500×10-3mol-6.000×10-3mol=2.500×10-3mol,所以n(Na2S):n(NaHS)= 6.000×10-3mol:2.500×10-3mol=12∶5。溶液中溶質(zhì)的物質(zhì)的量的比與所取溶液體積無關,因此原溶液中n(Na2S):n(NaHS)= 12∶5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
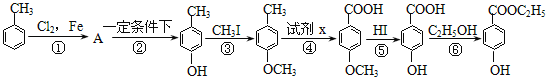
【題目】工業(yè)上用甲苯生產(chǎn)對-羥基苯甲酸乙酯:![]() ,下列反應①—⑥是其合成過程,其中某些反應條件及部分反應物或生成物未注明。
,下列反應①—⑥是其合成過程,其中某些反應條件及部分反應物或生成物未注明。
回答下列問題:
(1)有機物A的結構簡式為___________________。A的名稱為 。
(2)反應①的化學方程式是:____________________________________。
(3)試劑x是___________。
(4)反應⑥的化學方程式是:_____________________________________。
(5)合成路線中設計③、⑤兩步反應的目的是_____________
(6)CH3O-![]() -COOH的同分異構體中,既能與NaHCO3發(fā)生反應,又能與FeCl3溶液發(fā)生顯色反應的共有 種,其中核磁共振氫譜為5組峰,且峰面積比為2∶2∶2∶1∶1的為 (寫結構簡式)。
-COOH的同分異構體中,既能與NaHCO3發(fā)生反應,又能與FeCl3溶液發(fā)生顯色反應的共有 種,其中核磁共振氫譜為5組峰,且峰面積比為2∶2∶2∶1∶1的為 (寫結構簡式)。
(7)已知:![]() ,寫出以苯酚和乙醇為原料制備
,寫出以苯酚和乙醇為原料制備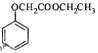 的合成路線流程圖(無機試劑任用)。合成路線流程圖例如下:
的合成路線流程圖(無機試劑任用)。合成路線流程圖例如下:
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近羅格斯大學研究人員利用電催化技術高效率將CO2轉化為X和Y(如下圖), X、Y可用作制備塑料、粘合劑和藥品的前體等。下列說法正確的是
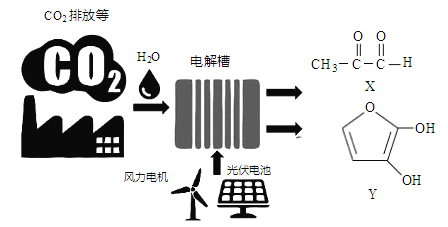
A. 圖中能量轉換方式只有2種
B. X、Y分子中所含的官能團相同
C. X、Y均是電解時的陽極產(chǎn)物
D. CO2資源化利用有利于解決大氣中CO2濃度增加導致的環(huán)境問題
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種可再生能源,具有廣闊的開發(fā)和應用前景,可用![]() 等作為催化劑,采用如下反應來合成甲醇:
等作為催化劑,采用如下反應來合成甲醇:![]()
(1)下表是有關化學鍵的鍵能數(shù)據(jù),計算表中的a=__________。
化學鍵 |
|
|
|
|
|
鍵能 | 436 | 462.8 | a | 1075 | 351 |
(2)將![]() 的混合氣體,勻速通過裝有催化劑的反應器反應(如圖甲),反應器溫度變化與從反應器排出氣體中
的混合氣體,勻速通過裝有催化劑的反應器反應(如圖甲),反應器溫度變化與從反應器排出氣體中![]() 的體積分數(shù)φ關系如圖乙,φ(CH3OH)變化的原因是__________。
的體積分數(shù)φ關系如圖乙,φ(CH3OH)變化的原因是__________。
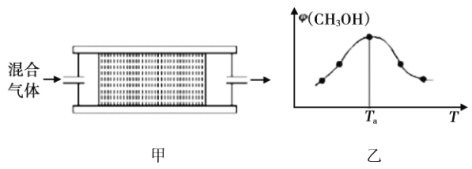
(3)某學習小組模擬工業(yè)合成甲醇的反應,在![]() 的恒容密閉容器內(nèi)充入
的恒容密閉容器內(nèi)充入![]() 和
和![]() ,加入合適催化劑后在某溫度下開始反應,并用壓力計監(jiān)測容器內(nèi)壓強的變化如表:
,加入合適催化劑后在某溫度下開始反應,并用壓力計監(jiān)測容器內(nèi)壓強的變化如表:
反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 |
壓強/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
從反應開始到![]() 時,
時,![]() 的平均反應速率為______,該溫度下的平衡常數(shù)
的平均反應速率為______,該溫度下的平衡常數(shù)![]() 為______。
為______。
(4)另將![]() 和
和![]() 加入密閉容器中,在一定條件下發(fā)生上述反應。平衡時
加入密閉容器中,在一定條件下發(fā)生上述反應。平衡時![]() 的體積分數(shù)(%)與溫度和壓強的關系如圖所示(虛線框表示沒有測定該條件下的數(shù)據(jù))。
的體積分數(shù)(%)與溫度和壓強的關系如圖所示(虛線框表示沒有測定該條件下的數(shù)據(jù))。
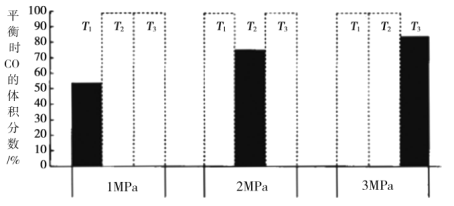
![]() 由大到小的關系是__________,判斷理由是__________。
由大到小的關系是__________,判斷理由是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個容積均為2L恒溫密閉容器中,起始時均充入amolH2S,控制不同溫度和分別在有、無Al2O3催化時進行H2S的分解實驗[反應為:2H2S(g)![]() 2H2(g)+S2(g)]。測得的結果如下圖所示(曲線Ⅱ、Ⅲ表示經(jīng)過相同時間且未達到化學平衡時H2S的轉化率)。
2H2(g)+S2(g)]。測得的結果如下圖所示(曲線Ⅱ、Ⅲ表示經(jīng)過相同時間且未達到化學平衡時H2S的轉化率)。
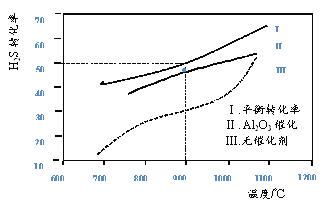
下列說法不正確的是
A. H2S分解為放熱反應
B. 加入Al2O3 可提高H2S的平衡轉化率
C. 900℃反應2H2S(g)![]() 2H2(g)+S2(g)的平衡常數(shù)K=0.125a
2H2(g)+S2(g)的平衡常數(shù)K=0.125a
D. 約1100℃曲線Ⅱ、Ⅲ幾乎重合,說明Al2O3可能幾乎失去催化活性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確的是
A. 制備無水氯化鐵
B. 配制一定濃度的硫酸溶液
C. 制取少量NH3 
D. 比較NaHCO3和Na2CO3的熱穩(wěn)定性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列根據(jù)實驗操作和現(xiàn)象所得出的結論正確的是
選項 | 實驗操作 | 實驗現(xiàn)象 | 結論 |
A | 將SO2氣體通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持續(xù)通入氣體Y | 先出現(xiàn)白色沉淀,最終沉淀又溶解 | Y可能是CO2氣體 |
C | AgCl懸濁液中滴入少量Na2S溶液 | 沉淀變黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的兩試管中分別加入淀粉溶液和AgNO3溶液 | 前者溶液變藍色,后者有黃色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從古至今,鐵及其化合物在人類生產(chǎn)生活中的作用發(fā)生了巨大變化。
(1)古代中國四大發(fā)明之一的指南針是由天然磁石制成的,其主要成分是______(填字母序號)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化學成分為:SiO2約45%,F(xiàn)e2O3約40%,Al2O3約10%,MgO約5%。用該廢渣制取藥用輔料——紅氧化鐵的工藝流程如下(部分操作和條件略):
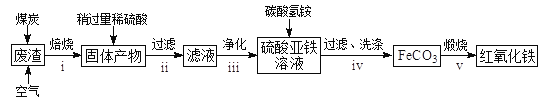
回答下列問題:
①在步驟i中產(chǎn)生的有毒氣體可能有__________________。
②在步驟iii操作中,要除去的離子之一為Al3+。若常溫時Ksp[Al(OH)3]=1.0×10-32,此時理論上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,則溶液的pH為____________。
③步驟iv中,生成FeCO3的離子方程式是_________________。
(3)氯化鐵溶液稱為化學試劑中的“多面手”,向氯化銅和氯化鐵的混合溶液中加入適量氧化銅粉末會產(chǎn)生沉淀,寫出該沉淀的化學式______________。這一過程的總反應的離子方程式______。
(4)古老而神奇的藍色染料普魯士藍的合成方法如下:

復分解反應ii的離子方程式是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fenton法常用于處理含難降解有機物的工業(yè)廢水,通常是在調(diào)節(jié)好pH和Fe2+濃度的廢水中加入H2O2,所產(chǎn)生的羥基自由基能氧化降解污染物,羥基自由基的產(chǎn)生與溶液pH大小有關。現(xiàn)運用該方法降解有機污染物p-CP,探究有關因素對該降解反應速率的影響。
(實驗過程)

用圖所示裝置進行如下表所示的實驗,控制p-CP的初始濃度相同,其余實驗條件見下表,設計如下對比實驗,最終測量的是p-CP濃度的改變量。
(實驗數(shù)據(jù))
實驗編號 | H2O2溶液 | Fe2+溶液 | 蒸餾水 | pH | 溫度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
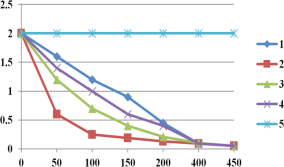
圖2實驗測得p-CP的濃度隨時間的變化
(分析與解釋)
(1)實驗③中,x=________。
(2)實驗①、⑤的目的是________。
(3)實驗①、②表明溫度升高,降解反應速率增大。但溫度過高是反而導致降解反應速率減少,從Fenton法所用試劑H2O2性質(zhì)的角度分析原因_____(請用化學用語解答)。
(4)通過實驗⑤可以得出結論是是pH等于10時,降解反應趨于停止,推測可能的原因:__。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com