
【題目】某無色稀溶液X中,可能含有如表所列離子中的某幾種.取該溶液適量,向其中加入某試劑Y,產生沉淀的物質的量(n)與加入試劑體積(y)的關系如圖所示.下列說法正確的是( )
陰離子 | CO32﹣、SiO32﹣、[Al(OH)4]﹣、Cl﹣ |
陽離子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
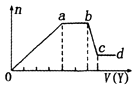
A.若Y是鹽酸,則X中一定含有CO32﹣、SiO32﹣、[Al(OH)4]﹣和NH4+
B.若Y是NaOH溶液,則X中一定含有A13+、Fe3+、NH4+、Cl﹣
C.若Y是NaOH溶液,則ab段發生反應的離子方程式為:NH4++OH﹣═NH3↑+H2O
D.若Y是NaOH溶液,則X中的Al3+、Mg2+、NH4+物質的量之比為2:1:4
【答案】D
【解析】解:溶液無色說明溶液中不含Fe3+;(1)如果Y是鹽酸,向溶液中加鹽酸,先生成沉淀,則溶液中可能含SiO32﹣、[Al(OH)4]﹣或兩者中的一種,即生成的沉淀為H2SiO3、Al(OH)3或兩者中的一種,則溶液中不含Al3+、Mg2+;當a﹣b段時,沉淀的量不變化,發生的是鹽酸和碳酸根離子反應生成氣體:CO32﹣+H+═HCO3﹣ , HCO3﹣+H+═H2O+CO2↑;當b﹣c段時沉淀的質量減少,即部分沉淀和鹽酸反應:Al(OH)3+3H+═Al3++3H2O,部分沉淀和鹽酸不反應,說明生成的沉淀既有H2SiO3又有Al(OH)3 , 原溶液中有SiO32﹣和[Al(OH)4]﹣ , 則oa段發生反應的離子方程式SiO32﹣+2H+═H2SiO3↓,[Al(OH)4]﹣+H+═Al(OH)3↓+H2O,由于SiO32﹣和[Al(OH)4]﹣和銨根離子能雙水解,所以溶液中不含NH4+ , 含有的陽離子是Na+ . 則X中一定含有的離子是CO32﹣、SiO32﹣、AlO2﹣、Na+ , oa段發生反應的離子方程式SiO32﹣+2H+═H2SiO3↓,[Al(OH)4]﹣+H+═Al(OH)3↓+H2O,ab段發生反應的離子方程式CO32﹣+H+═HCO3﹣ , HCO3﹣+H+═H2O+CO2↑,bc段發生反應的離子方程式:Al(OH)3+3H+═Al3++3H2O.
綜上可知含有的離子為:CO32﹣、SiO32﹣、AlO2﹣、Na+;(2)若Y是氫氧化鈉,向溶液中加氫氧化鈉溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或兩者中的一種,由于弱堿陽離子和弱酸根會雙水解而不能共存,即溶液中不含CO32﹣、SiO32﹣、[Al(OH)4]﹣ , 由于溶液一定要保持電中性,故溶液中一定含Cl﹣;當a﹣b段時,沉淀的量不變化,是氫氧化鈉和銨根離子反應生成氣體:NH4++OH﹣═NH3H2O,即溶液中含NH4+;當b﹣c段時沉淀的質量減少但沒有完全溶解,即部分沉淀和氫氧化鈉反應,部分沉淀不反應,說明溶液中有Al3+、Mg2+ , 即bc段的反應為:Al(OH)3+OH﹣═AlO2﹣+2H2O.
綜上可知,X中一定含有的離子是Al3+、Mg2+、NH4+、Cl﹣;
A.由分析可知,若Y是鹽酸,則X中一定含有:CO32﹣、SiO32﹣、AlO2﹣、Na+ , 故A錯誤;
B.若Y是氫氧化鈉,X中一定含有的離子是Al3+、Mg2+、NH4+、Cl﹣ , 沒有Fe3+ , 故B錯誤;
C.若Y是NaOH溶液,當a﹣b段時,沉淀的量不變化,是氫氧化鈉和銨根離子反應生成氣體:NH4++OH﹣═NH3H2O,故C錯誤;
D.與銨根離子反應需要氫氧化鈉的體積是2v,氫氧化鋁和氫氧化鈉反應需要氫氧化鈉的體積是1v,則生成氫氧化鋁需要氫氧化鈉的體積是3V,生成氫氧化鎂需要氫氧化鈉的體積是1V,則n(Al3+):n(Mg2+):n(NH4+)=1: ![]() :2=2:1:4,故D正確.
:2=2:1:4,故D正確.
故選D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】將鋁粉與某鐵的氧化物FeO2Fe2O3粉末配制成鋁熱劑,分成兩等份.一份直接放入足量的燒堿溶液中,充分反應后放出氣體在標準狀況下的體積為15.68L;另一份在高溫下恰好反應完全,反應后的混合物與足量的鹽酸反應后,放出的氣體在標準狀況下的體積為( )
A.11.20L
B.15.68L
C.22.40L
D.31.36L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、X均為中學常見物質,它們在一定條件下有如下轉化關系(副產物已略去)。
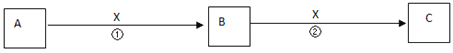
(1)若X是氧氣,則A不可能______________A.CB.Si C.NaD.Mg
(2)若X是金屬單質,向C的水溶液中滴入AgNO3溶液,產生了不溶于稀HNO3的白色沉淀,則B的化學式為__________;C溶液在貯存時應加入少量X,理由是(用離子方程式表示)___________ 。檢驗B溶液中陽離子的操作方法是_________________。
(3)若X是氫氧化鈉溶液,A、B、C均為含鋁元素的化合物,則反應②的離子方程式為________________
(4)若X為鹽酸,A、B、C均不含鋁元素,且反應②有無色無味氣體生成,則反應①的離子方程式為___________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g)2NH3(g)△H<0,下列各項對示意圖的解釋與圖象相符的是( ) 
A.①壓強對反應的影響(p2>p1)
B.②溫度對反應的影響
C.③平衡體系增加N2對反應的影響
D.④催化劑對反應的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定的條件下,下列選項所示的物質間轉化均能實現的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由反應物X 轉化為Y 和Z的能量變化如圖所示.下列說法正確的是( ) 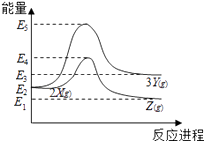
A.由X→Y反應的△H=E5﹣E2
B.由X→Z反應的△H>0
C.降低壓強有利于提高Y的產率
D.升高溫度有利于提高Z的產率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電解質的說法,正確的是
A. 金屬導電,屬于電解質 B. 乙酸是有機物,屬于非電解質
C. 只有在水溶液中能夠導電的物質才屬于電解質 D. NaCl和Al2O3在熔融狀態下均導電,都屬于電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣和氧氣在某催化劑和不同溫度下生成的產物如圖所示.已知在800℃下,容積固定的密閉容器中發生反應①、②:
4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ①
2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ②
4NO(g)+6H2O(g) ②
下列描述可說明兩反應均達到平衡的是( )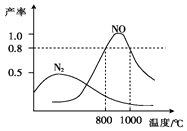
A.v(N2)=v(NO)
B.反應①的焓變△H保持恒定
C.體系的密度不再發生變化
D.混合氣體的平均相對分子質量不再發生變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com