
| A. | 具有下列電子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半徑最大的是① | |
| B. | 下列原子的價電子排布中,①3s23p1 ②3s23p2 ③3s23p3④3s23p4,對應的第一電離能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的電負性隨原子序數的增加而遞增的是④ | |
| D. | 某元素的逐級電離能(kJ•mol-1)分別為738、1451、7733、10540、13630、17995、21703,當它與氯氣反應時最可能生成的陽離子是X3+ |
分析 A、①1s22s22p63s23p2 是硅,②1s22s22p3 是氮,③1s22s22p2 是碳,④1s22s22p63s23p4是硫;
B、當最外層處于半充滿或全充滿時,難以失去電子,則第一電離能最大;
C、同周期自左而右電負性增大,同主族自上而下電負性減小;
D、該元素第三電離能劇增,最外層應有2個電子,表現+2價.
解答 解:A、①1s22s22p63s23p2 是硅,②1s22s22p3 是氮,③1s22s22p2 是碳,④1s22s22p63s23p4是硫,電子層數越多半徑越大,電子層數相同時,核電荷數越鑫半徑越小,所以原子半徑最大的是硅,故A正確;
B、①3s23p1 ②3s23p2 ③3s23p3④3s23p4,依次是Al、Si、P、S,同周期第二和第五主族元素的電離能大于相鄰有其它元素,所以P的第一電離能最大,故B正確;
C、同周期自左而右電負性增大,同主族自上而下電負性減小,故①Na、K、Rb電負性依次減小,②N、P、As的電負性依次減小,③O、S、Se的電負性依次減小 ④Na、P、Cl的電負性依次增大,故C正確;
D、該元素第三電離能劇增,最外層應有2個電子,表現+2價,當它與氯氣反應時最可能生成的陽離子是X2+,故D錯誤;
故選:D.
點評 本題考查核外電子排布、微粒半徑比較、電離能與電負性等,難度中等,注意理解電離能與元素化合價關系、同周期第一電離能發生突躍原理.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 該條件下反應的平衡常數為1.6×103 | |
| B. | 通常情況下,該反應一定能自發進行 | |
| C. | 題給條件下,SO2的轉化率是80% | |
| D. | 當體系中SO2和SO3的速率之比是1:1時,則該反應達到化學平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
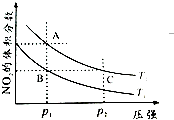 氮可形成多種氣態氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的結構式分別是
氮可形成多種氣態氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的結構式分別是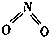 和
和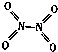 .實驗測得N-N鍵的鍵能為167kJ•mol-1,NO2中氮氧鍵的鍵能為 466kJ•mol-1,N2O4中氮氧鍵的鍵能為438.5kJ•mol-1.
.實驗測得N-N鍵的鍵能為167kJ•mol-1,NO2中氮氧鍵的鍵能為 466kJ•mol-1,N2O4中氮氧鍵的鍵能為438.5kJ•mol-1.| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 酸性:H2SiO3<H2CO3 | B. | 堿性:Mg(OH)2>Al(OH)3 | ||
| C. | 穩定性:SiH4>PH3 | D. | 原子半徑:N<C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11:2 | B. | 9:4 | C. | 1:1 | D. | 5:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com