
| Fe3+ | Fe2+ | Cu2+ | |
| 氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 氫氧化物完全沉淀時的pH | 3.2 | 9.0 | 6.7 |
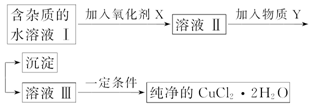
分析 氯化亞鐵和氯化銅的混合液中,加入氧化劑可以將亞鐵離子氧化為鐵離子,調節pH可以將鐵離子沉淀,得到氯化銅的水溶液,然后再酸性環境下蒸發濃縮、冷卻結晶,過濾、洗滌、干燥即可得到氯化銅晶體,
(1)加入氧化劑,將Fe2+氧化為Fe3+,易除去;
(2)選擇的氧化劑不能引進新的雜質離子;
(3)在調節pH時,加入的物質不能引進新雜質;
(4)在調節pH時,加入的物質不能引進新雜質.
解答 解:(1)根據實驗目的,加入氧化劑的目的是將Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而與Cu2+分離,
故答案為:將Fe2+氧化為Fe3+,Fe3+便于生成沉淀與Cu2+分離;
(2)根據實驗目的,加入氧化劑的目的是將Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而與Cu2+分離,K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能將亞鐵離子氧化,但是K2Cr2O7、NaClO、KMnO4能引進新的雜質離子,雙氧水是綠色氧化劑,得到的還原產物是水,不會引進雜質離子,反應的離子方程式為2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案為:C;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)中和溶液的酸性,調節pH,將鐵離子沉淀,銅離子不沉淀,可以加入CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3],注意不能引入新雜質,
故答案為:C;
(4)銅離子水解溶液顯示酸性,加熱蒸干硫酸銅溶液得到的是氫氧化銅,為防止水解,應該在HCl氣流中蒸干,
故答案為:不能;應在HCl氛圍中加熱蒸發.
點評 本題綜合考查物質的分離、提純,為高考常見題型,題目涉及氧化還原反應原理的應用、調節pH除雜質、鹽的水解原理的應用等,考查學生分析解決問題以及靈活應用所學知識的能力,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 萃取時將萃取劑直接注入漏斗中 | |
| B. | 萃取操作完成后,靜置分層,上下層液體依次從下口放出 | |
| C. | 用一種有機溶劑,提取水溶液中的某物質,靜置分層,“水層”必須在上層 | |
| D. | 萃取時所選溶劑應與原溶劑互不相溶,且與溶質不反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol/L的KNO3溶液:Na+、Fe2+、Cl-、SO42- | |
| B. | 含有NaOH的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 能與Al反應生成H2的溶液:NH4+、K+、NO3-、Cl- | |
| D. | 飽和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
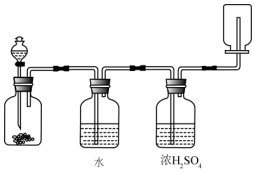
| A. | 鋅和鹽酸生成氫氣 | B. | 氯酸鉀和二氧化錳生成氧氣 | ||
| C. | 碳酸鈣和鹽酸生成二氧化碳 | D. | 氯化鈉和濃硫酸生成氯化氫 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
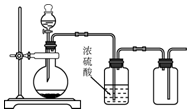
| A. | 用鋅和稀硫酸制備H2 | B. | 用銅和稀硝酸制備NO | ||
| C. | 用30%H2O2水溶液和MnO2制備O2 | D. | 用MnO2和濃鹽酸制備Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com