
【題目】廢棄物的綜合利用既有利于節約資源,又有利于保護環境。實驗室利用廢舊電池的銅帽(Cu、Zn 總含量約為99%)回收Cu并制備ZnO 的部分實驗過程如下: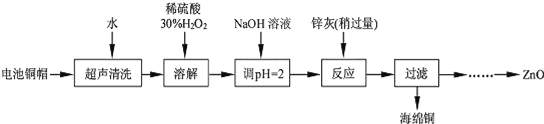
(1)寫出銅帽溶解時銅與加入的稀硫酸、30%H2O2 反應的離子反應方程式______________________;銅帽溶解完全后,需加熱(至沸)將溶液中過量的H2O2除去。
(2)為確定加入鋅灰(主要成分為Zn、ZnO,雜質為鐵及其氧化物)的量,實驗中需測定除去H2O2 后溶液中Cu2+的含量。實驗操作為:準確量取一定體積的含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節溶液pH=3~4,加入過量的KI,用Na2S2O3標準溶液滴定至終點。上述過程中反應的離子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣
①滴定選用的指示劑為______________,滴定終點觀察到的現象為_______________________________;
②某同學稱取1.0g電池銅帽進行實驗,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節溶液pH=3~4,加入過量的KI,用0.1000mol/L Na2S2O3標準溶液滴定至終點。再重復操作實驗3次,記錄數據如下:
實驗編號 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
計算電池銅帽中Cu的質量分數為__,(結果保留四位有效數字)若滴定前溶液中的H2O2沒有除盡,則所測定c (Cu2+)將會__(填“偏高”、“偏低”或“無影響”);
(3)常溫下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10﹣20,計算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11 時Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣。下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH 按金屬離子濃度為1.0molL﹣1計算)。
開始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
實驗中可選用的試劑:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH。由除去銅的濾液制備ZnO的實驗步驟依次為:①向濾液中加入適量30% H2O2,使其充分反應;
②加入適量的1.0molL﹣1NaOH調節pH,產生沉淀;③過濾;
④______________;⑤過濾、洗滌、干燥;⑥900℃煅燒。
【答案】 Cu+H2O2+2H+=Cu2++2H2O 淀粉溶液 藍色褪去 80.99% 偏高 2×10﹣10 向濾液中滴加1.0molL﹣1NaOH,調節溶液8.9≤pH≤11,使Zn2+沉淀完全
【解析】(1)因為雙氧水在酸性溶液中先把銅氧化成氧化銅,當然這是一個微弱的反應,形成一個平衡,但是形成的氧化銅馬上就會被稀硫酸溶解,平衡被打破,反應朝正方向進行,故而逐漸溶解,反應的離子方程式為Cu+H2O2+2H+=Cu2++2H2O。
(2)①淀粉溶液為指示劑,當最后一滴Na2S2O3溶液滴入時,溶液藍色褪去,半分鐘顏色不變,說明滴定到達終點,故答案為:淀粉溶液,藍色褪去;
②舍去實驗1數據,求其它三組實驗數據平均值為25.31mL,由2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣得到關系式:2Cu2+——I2——2S2O32﹣,
n(Cu2+)=n(S2O32﹣)=25.31mL×10﹣3×0.1000mol/L,電池銅帽中Cu的質量分數為25.31mL×10﹣3×0.1000mol/L×5×64g/mol/1.0g=80.99%。若留有H2O2,加入KI后,會有以下反應:H2O2+2I-+2H+=I2+2H2O,誤當成2Cu2++4I-=2CuI(白色)↓+I2生成的碘,使測定結果偏高,故答案為:偏高;
(3)向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,反應后溶液中剩余c(OH—)=1.0×10-5,KSP[Cu(OH)2]=2.0×10﹣20=c(Cu2+)×c2(OH—),c(Cu2+)=2×10﹣10 。
(4)①向濾液中加入30%H2O2,使其充分反應,目的使Fe2+轉化完全為Fe3+,滴加NaOH溶液,調節溶液PH約為5(或3.2≤pH<5.9),使Fe3+沉淀完全,向濾液中滴加1.0molL-1NaOH,調節溶液PH約為10(或8.9≤pH≤11),使Zn2+沉淀完全,900℃煅燒,制得氧化鋅。


科目:高中化學 來源: 題型:
【題目】下列示意圖中,白球代表氫原子,黑球代表氦原子,方框代表容器,容器中間有一個可以上下滑動的隔板(其質量忽略不計).其中能表示等質量的氫氣與氦氣的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對以下科學家的發明發現,分析不合理的是( )
A.屠呦呦研究小組發現抗瘧新藥青蒿素,幫助很多人擺脫了瘧疾的威脅
B.侯德榜制堿法,最終制得純堿的化學式為:NaHCO3
C.阿伏加德羅提出分子學說,使人們對物質結構的認識發展到一個新的階段
D.門捷列夫發現元素周期律,使化學的研究變得有規律可循
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某無色酸性溶液中能大量共存的一組離子是
A. Na+、K+、HCO3-、NO3- B. Mg2+、SO42-、Al3+、NO3-
C. Na+、Ca2+、 NO3-、CO32- D. K+、MnO4-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國知名企業比亞迪公司開發了具有多項專利的鋰釩氧化物二次電池,其成本較低,對環境無污染,能量密度遠遠高于其他電池,電池總反應為V2O5 + xLi![]() LixV2O5。下列說法合理的是( )
LixV2O5。下列說法合理的是( )
A. 電池在放電時,Li+向負極移動
B. 鋰在放電時作正極,充電時作陽極
C. 該電池充電時陽極的反應為LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是鋰發生反應的載體,不參與電池反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2020年抗擊新冠肺炎的戰役中,化學物質發揮了重要作用。下列說法正確的是( )
A.醫用消毒酒精中乙醇的體積分數為95%
B.生產醫用防護口罩的原料聚丙烯纖維屬于純凈物
C.抗病毒疫苗冷藏存放的目的之一是避免蛋白質變性
D.84消毒液可作為環境消毒劑,其有效成分為次氯酸鈣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com