
【題目】碳酸氫納俗稱“小蘇打”,是氨堿法和聯合制堿法制純堿的中間產物,可用作膨松劑,制酸劑,滅火劑等。工業上用純堿溶液碳酸化制取碳酸氫鈉。
(1)某碳酸氫鈉樣品中含有少量氯化鈉。稱取該樣品,用0.1000mol/L鹽酸滴定,耗用鹽酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留兩位小數)。
(2)某溶液組成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
質量(kg) | 814.8 | 400.3 | 97.3 |
問該溶液通入二氧化碳,析出碳酸氫鈉晶體。取出晶體后溶液組成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
質量(kg) | 137.7 | 428.8 | 97.3 |
計算析出的碳酸氫鈉晶體的質量(保留1位小數)。____________
(3)將組成如表二的溶液加熱,使碳酸氫鈉部分分解,溶液中NaHCO3的質量由428.8kg降為400.3kg,補加適量碳酸鈉,使溶液組成回到表一狀態。計算補加的碳酸鈉質量(保留1位小數)。____________
(4)某種由碳酸鈉和碳酸氫鈉組成的晶體452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(標準狀況),獲得純的碳酸氫鈉溶液,測得溶液中含碳酸氫鈉504kg。通過計算確定該晶體的化學式____________
【答案】17.80 1044.6 659.1 NaHCO3·Na2CO3·2H2O
【解析】
(1)根據碳酸氫鈉樣品消耗的氫離子物質的量相等,計算出消耗硫酸的體積;
(2)先求出通入二氧化碳消耗的碳酸鈉的質量,然后根據反應計算出生成的碳酸氫鈉的質量,再計算析出的碳酸氫鈉的質量;
(3)根據碳酸氫鈉減少的質量,計算出生成的碳酸鈉的質量,再用814.8kg減掉現有的碳酸鈉質量,就是需要添加的碳酸鈉質量;
(4)先根據二氧化碳的體積計算出生成的碳酸氫鈉和反應的碳酸鈉質量,反應后溶液中含碳酸氫鈉504kg,減掉生成的碳酸氫鈉,得到原晶體中的碳酸氫鈉質量,最后計算出水的質量,就可以求出晶體的化學式。
(1)根據反應可知消耗的H2SO4物質的量是HCl的一半,即0.1×20×0.5=0.05618×V,V=1780mL。
(2)
(2)設生成的碳酸氫鈉質量為m,向溶液中通入二氧化碳,發生了反應:Na2CO3+CO2+H2O=2NaHCO3,反應消耗的碳酸鈉的質量是:814.8kg-137.7kg=677.1kg![]()
m=![]() =1073.1kg,則析出的碳酸氫鈉晶體的質量:1073.1+400.3-428.8=1044.6 kg
=1073.1kg,則析出的碳酸氫鈉晶體的質量:1073.1+400.3-428.8=1044.6 kg
(3)
x=17.98 kg,則補加的碳酸鈉質量814.8-137.7-17.98=659.1 kg.
(4)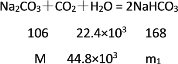
m=212 kg,m1=336 kg,則452kg晶體中含Na2CO3212 kg,NaHCO3168 kg,水72 kg,
因此該晶體的化學式為NaHCO3·Na2CO3·2H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】二氧化硫是造成大氣污染的主要有害氣體之一,工業制備硫酸的接觸室中二氧化硫不能完全轉化為三氧化硫,尾氣必須處理。某興趣小組模擬接觸室中反應,如圖是分別在三種不同實驗條件下進行反應,反應物二氧化硫的濃度隨時間的變化。
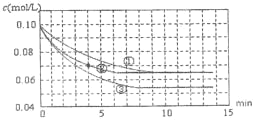
(1)工業制硫酸的接觸室中用二氧化硫與氧氣制三氧化硫的生產條件為_______。
(2)實驗②,0~4min 平均反應速率v(O2)=______。
(3)實驗③可能改變的條件是什么:______請簡述理由。______(已知正反應放熱)
(4)二氧化硫尾氣可以用氨水吸收,最終的產物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物質的量濃度相同時,銨根離子濃度由大到小的順序為______。
(5)濃硫酸是常見的干燥劑,請解釋不能干燥硫化氫與氨氣的原因_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列生產、生活等實際應用,不能用勒夏特列原理解釋的是( )
A.實驗室中配制FeCl3溶液時,應向其中加入少量濃鹽酸
B.合成氨工業中使用鐵觸媒做催化劑
C.飽和FeCl3溶液滴入沸水中可制得氫氧化鐵膠體
D.熱的純堿溶液去油污效果好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如表。甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素,下列判斷正確的是
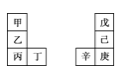
A.丙與庚的原子序數相差3
B.氣態氫化物的熱穩定性:戊>己>庚
C.乙所在周期元素中,其簡單離子的半徑最大
D.常溫下甲的單質在水中反應要比乙劇烈很多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁質輕且有良好的防腐蝕性,在國防工業中有非常重要的作用。完成下列填空:
(1)鋁原子核外電子云有___種不同的伸展方向,有___種不同運動狀態的電子。
(2)鎵(Ga)與鋁同族。寫出鎵的氯化物和氨水反應的化學方程式___。
(3)硅與鋁同周期。SiO2是硅酸鹽玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可寫成氧化物形式___。盛放NaOH溶液的試劑瓶若用玻璃瓶塞容易形成粘性的硅酸鹽而無法打開,發生反應的化學方程式為___。長石是鋁硅鹽酸,不同類長石其氧原子的物質的量分數相同。由鈉長石化學式NaAlSi3O8可推知鈣長石的化學式為___。
(4)用鋁和金屬氧化物反應制備金屬單質是工業上常用的方法。如:2Al+4BaO![]() 3Ba↑+BaOAl2O3。常溫下Al的金屬性比Ba的金屬性___(選填“強”“弱”)。利用上述方法可制取Ba的主要原因是___。
3Ba↑+BaOAl2O3。常溫下Al的金屬性比Ba的金屬性___(選填“強”“弱”)。利用上述方法可制取Ba的主要原因是___。
a.高溫時Al的活潑性大于Ba b.高溫有利于BaO分解
c.高溫時BaOAl2O3比Al2O3穩定 d.Ba的沸點比Al的低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖裝置探究鐵在海水中的電化學防護,下列說法不正確的是

A.若X為鋅棒,開關K置于M處,可減緩鐵的腐蝕
B.若X為鋅棒,開關K置于M處,鐵電極的反應:Fe2e =Fe2+
C.若X為碳棒,開關K置于N處,可減緩鐵的腐蝕
D.若X為碳棒,開關K置于N處,鐵電極的反應:2H++2e=H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CH4(g)+2O2(g)= CO2(g)+2H2O(l); △H=-890kJ/mol。當一定量的CH4 (g) 完全燃燒生成CO2(g)和H2O(l) 所放出的熱量為74kJ時,所需要空氣在標況下的體積約為(空氣中N2:O2體積比為4:1計) ( )
A.37.24LB.18.62LC.9.3LD.20.50L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷及部分重要化合物的相互轉化如圖所示。
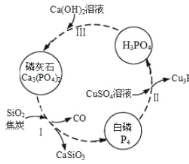
(1)不慎將白磷沾到皮膚上,可用0.2mol/L CuSO4溶液沖洗,根據步驟Ⅱ可判斷,1mol CuSO4所能氧化的白磷的物質的量為______。
(2)步驟Ⅲ中,反應物的比例不同可獲得不同的產物,除Ca3(PO4)2外可能的產物還有______。
磷灰石是生產磷肥的原料,它的組成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析結果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
質量分數(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的質量分數為______%(保留兩位小數)。
(4)取100g磷灰石粉末,加入足量的濃硫酸,并加熱,鈣元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留兩位小數)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸為0.5mol/L、硫酸為0.1mol/L)與其反應,結果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的單質及其化合物性質多樣,用途廣泛。完成下列填空:
科學家正在研究利用催化技術將超音速飛機尾氣中的NO和CO轉變成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某溫度下測得該反應在不同時間的CO濃度如下表:
濃度(mol/L) 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)該反應平衡常數K的表達式為___;溫度升高,K值___(選填“增大”“減小”“不變”);前2s的平均反應速率v(N2)=___;若上訴反應在密閉容器中發生,達到平衡時能提高NO轉化率的措施之一是___。
(2)工業合成氨的反應溫度選擇500℃左右的原因是___。
(3)實驗室在固定容積的密閉容器中加入1mol氮氣和3mol氫氣模擬工業合成氨,反應在一定條件下已達到平衡的標志是___。
A.N2、H2、NH3的濃度之比為1:3:2
B.容器內的壓強保持不變
C.N2、H2、NH3的濃度不在變化
D.反應停止,正、逆反應的速率都等于零
(4)常溫下向1molHCl的稀鹽酸中緩緩通入1molNH3(溶液體積變化忽略不計),反應結束后溶液中離子濃度由大到小的順序是___;在通入NH3的過程中溶液的導電能力___(選填“變大”“變小”“幾乎不變”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com