
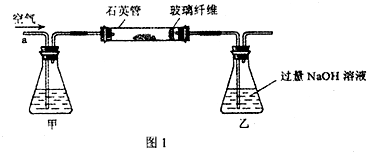
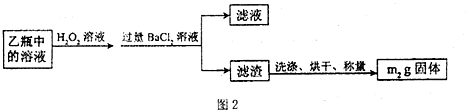
| 11 |
| 4 |
| 1 |
| 2 |
| 11 |
| 4 |
| 1 |
| 2 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |
| 11 |
| 4 |
| 1 |
| 2 |
| m2 |
| 233 |
| m2 |
| 233 |
| m2 |
| 233 |
| 32m2 |
| 233m1 |
| 5CV× 10-3×10mol× 56g/mol |
| m1 |
| 2.8CV |
| m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |


 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源:2007年普通高等學校招生全國統一考試、化學(廣東卷) 題型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)將0.050 mol SO2(g)和0.030 mol O2(g)放入容積為![]() 2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol·L-1。計算該條件下SO2的平衡轉化率(寫出計算過程)。
2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol·L-1。計算該條件下SO2的平衡轉化率(寫出計算過程)。
(2)已知上述反應是放熱反應,當該反應處于平衡狀態時,在體積不變的條件下,下列措施中有利于提高SO2平衡轉化率的有___________(填字母)。
A.升高溫度 B.降低溫度 C.增大壓強 D.減小壓強 E.加入催化劑 F.移出氧氣
(3)SO2尾氣用飽和Na2SO3溶液吸收可得到更重要的化工原料,反應的化學方程式為___________________________。
(4)將黃鐵礦的煅燒產物Fe3O4溶于H2SO4后,加入鐵粉,可制備FeSO4。酸溶過程中需保持溶液足夠酸性,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年四川省眉山市高三第一次診斷性考試化學試卷(解析版) 題型:填空題
硫酸渣是用黃鐵礦制造硫酸過程中排出的廢渣,主要化學成分為SiO2約45%,Fe2O3約40%,Al2O3約10%,MgO約5%。目前我國已經在技術上取得突破——從硫酸渣中分離出各種成分并加以利用。其流程和相關數據如下:

查資料得知:
|
物質名稱 |
溶度積(Ksp) |
pH值 |
|
|
開始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
請回答下列問題:
(1)寫出固體A的化學式為 。
(2)若要測定溶液的pH是否達到3.7,下列實驗用品中可選用的是 。
A.石蕊試液 B.廣泛pH試紙 C.精密pH試紙 D.pH計
(3)完成下列離子反應方程式
①溶液D生成固體E ; ②溶液F生成固體G 。
(4)要將固體C、固體E和固體G都轉化為相應的穩定氧化物,需進行的實驗操作為 。
(5)若不考慮溶液體積的變化,請計算溶液H中c(Mg2+)= 。
查看答案和解析>>
科目:高中化學 來源:同步題 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:
化學工業在國民經濟中占有極其重要的地位,江蘇省是國內最早的硫酸生產基地之一。主要方程式和主要設備: (黃鐵礦的主要成分為FeS2) 4FeS2+11O2 = 2Fe2O3+8SO2 (沸騰爐) 2SO2+O2![]() 2SO3 (接觸室) SO3+H2O=H2SO4(吸收塔)
2SO3 (接觸室) SO3+H2O=H2SO4(吸收塔)
(1)硫酸生產中,根據化學平衡原理來確定的條件或措施有 (填寫序號)。
A.礦石加入沸騰爐之前先粉碎 B.接觸室的反應使用V2O5作催化劑
C.接觸室中不使用很高的溫度 D.凈化后爐氣中要有過量的空氣
E.接觸室中的氧化在常壓下進行 F.吸收塔中用98.3%的濃硫酸吸收SO3
(2)0.1mol/L的NaHSO3溶液中,有關粒子濃度由大到小的順序為:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
①該溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用離子方程式表示): 。
②現向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可觀察到的現象是 ,反應的離子方程式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com