
氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,實驗室制備少量Mg(ClO3)2·6H2O的流程如下:

已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
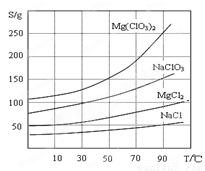
②四種化合物的溶解度(S)隨溫度(T)變化曲線如圖所示。

(1)過濾所需要的主要玻璃儀器有 ,加MgO后過濾所得濾渣的主要成分為 。
(2)加入BaCl2的目的是除去SO42-,如何檢驗SO42-已沉淀完全?答: 。
(3)加入NaClO3飽和溶液發生反應為:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再進一步制取Mg(ClO3)2·6H2O的實驗步驟依次為:① ;② ;③ ;④過濾、洗滌。
(4)產品中Mg(ClO3)2·6H2O含量的測定:
步驟1:準確稱量3.50 g產品配成100 mL溶液。
步驟2:取10 mL于錐形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的
FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100 mol·L-1 K2Cr2O7 溶液滴定至終點,此過程中反應的離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7 溶液15.00 mL。
①寫出步驟2中發生反應的離子方程式:
②產品中Mg(ClO3)2·6H2O的質量分數為 。
(1)漏斗、玻璃棒、燒杯 BaSO4和Fe(OH)3
(2)靜置,取上層清液加入BaCl2,若無白色沉淀,則SO42-沉淀完全
(3)蒸發結晶 趁熱過濾 冷卻結晶
(4)①ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O(2分)
②78.3%(3分)
【解析】
試題分析: (1)加入高錳酸鉀將Fe2+氧化為Fe3+,加入氯化鋇形成硫酸鋇沉淀,加入氧化鎂調節pH=4將Fe3+形成氫氧化鐵沉淀,過濾所得濾渣為硫酸鋇和氫氧化鐵,過濾需使用的玻璃儀器有漏斗、燒杯和玻璃棒。(2)靜置,向上層清液中繼續滴加氯化鋇溶液,若無白色沉淀生成,說明SO42-沉淀完全。(3)相同條件下,四種物質中氯化鈉溶解度最小,所以加入氯酸鈉溶液后,蒸發濃縮,氯化鈉析出,趁熱過濾,濾液為氯酸鎂溶液,將濾液降溫結晶得到氯酸鎂晶體。(4)ClO3-與Fe2+生成Cl-和Fe3+,離子方程式為ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O。錐形瓶中過量的Fe2+物質的量為0.009mol,與ClO3-反應的Fe2+為0.011mol,所以Mg(ClO3)2·6H2O物質的量為0.011/12mol,Mg(ClO3)2·6H2O質量分數為0.783。
考點: 化學實驗 離子方程式的書寫 化學計算


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源:2013-2014學年江西省新余市高三上學期期末質量檢測化學試卷(解析版) 題型:實驗題
氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,實驗室制備少量Mg(ClO3)2·6H2O的流程如下:
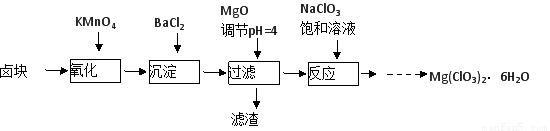
已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
②四種化合物的溶解度(S )隨溫度(T )變化曲線如圖所示。
(1)過濾所需要的主要玻璃儀器有??????????? 。
(2)加入BaCl2的目的是???????? ,加MgO后過濾所得濾渣的主要成分為???????????? 。
(3)加入NaClO3飽和溶液后發生反應的化學方程式為?????????????????????????????
(4)產品中Mg(ClO3)2·6H2O含量的測定:
步驟1:準確稱量3.50 g產品配成100 mL溶液。
步驟2:取10.00 mL于錐形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100 mol·L-1 K2Cr2O7? 溶液滴定剩余的Fe2+至終點,此過程中反應的離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7??? 溶液15.00 mL。
①寫出步驟2中發生反應的離子方程式:???????????????????????????????????????? ;
②產品中Mg(ClO3)2·6H2O的質量分數為?????????? 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市閔行區高三上學期期末教學質量檢測化學試卷(解析版) 題型:填空題
氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,實驗室制備少量Mg(ClO3)2·6H2O的流程如下:
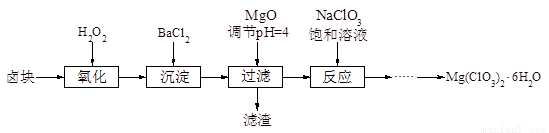
已知:
①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
②幾種化合物的溶解度(S)隨溫度(T)變化曲線如圖。

(1)加MgO后過濾所得濾渣的主要成分為 。
(2)加入BaCl2的目的是除去SO42-,如何檢驗SO42-已沉淀完全? 。
(3)加入NaClO3飽和溶液會發生如下反應:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
請利用該反應,結合右圖,制取Mg(ClO3)2·6H2O的實驗步驟依次為:
①取樣,加入NaClO3飽和溶液充分反應,② ;③ ;④ ;⑤過濾、洗滌,獲得Mg(ClO3)2·6H2O晶體。
產品中Mg(ClO3)2·6H2O含量的測定:
步驟1:準確稱量3.50g產品溶解定容成100mL溶液。
步驟2:取10mL于錐形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100mol/LK2Cr2O7溶液滴定至終點,此過程中反應的離子方程式為:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述產品測定中需要檢查是否漏液的儀器有 。
步驟3中若滴定前不用標準液潤洗滴定管,會導致最終結果偏 。(填“大”或“小”)。
(5)產品中Mg(ClO3)2·6H2O的質量分數為 。(計算結果保留兩位小數)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北省八校高三第一次聯考理綜化學試卷(解析版) 題型:填空題
氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,實驗室制備少量Mg(ClO3)2·6H2O的流程如下:

已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
②四種化合物的溶解度(S)隨溫度(T)變化曲線如圖所示。

(1)過濾所需要的主要玻璃儀器有 ,
(2)加入BaCl2的目的是 ,加MgO后過濾所得濾渣的主要成分為 。
(3)加入NaClO3飽和溶液后發生反應的化學方程式為 ,再進一步制取Mg(ClO3)2·6H2O的實驗步驟依次為:①蒸發結晶;② ;③ ;④過濾、洗滌。
(4)產品中Mg(ClO3)2·6H2O含量的測定:
步驟1:準確稱量3.50 g產品配成100 mL溶液。
步驟2:取10.00 mL于錐形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至終點,此過程中反應的離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7 溶液15.00 mL。
①寫出步驟2中發生反應的離子方程式: ;
②產品中Mg(ClO3)2·6H2O的質量分數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com