
能說明元素X的原子得電子能力強于元素Y的原子的事實是( )
A.元素周期表中元素X位于元素Y的上一個周期
B.元素X的含氧酸的酸性強于元素Y的含氧酸
C.分別加熱H2X、HY至500 ℃,只有HY發生分解
D.元素X與Y同主族,相同溫度時其單質與銅反應分別生成Cu2X和CuY
科目:高中化學 來源:2014高考化學二輪專題突破 專題十四常見有機物及其應用練習卷(解析版) 題型:選擇題
下列說法正確的是( )
A.1 mol葡萄糖水解能生成2 mol CH3CH2OH和2 mol CO2
B.向雞蛋清中分別加入Na2SO4的濃溶液和CuSO4的濃溶液,都會因鹽析而產生沉淀
C.油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高級脂肪酸
D.欲檢驗蔗糖水解的產物是否具有還原性,可向其水解后的溶液中直接加入新制Cu(OH)2懸濁液并加熱
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題十三無機化學綜合應用練習卷(解析版) 題型:實驗題
氯氣是一種重要的化工原料。某學習小組在實驗室中利用下圖所示裝置制取氯氣并探究其性質。
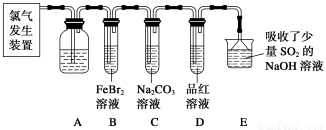
(1)實驗室用二氧化錳和濃鹽酸加熱制取氯氣,發生裝置中除圓底燒瓶和導管外還需用到的玻璃儀器有__________________。
(2)裝置A中盛有的試劑是________,作用是___________________________________。
(3)若D中品紅溶液褪色,則B裝置中發生反應的離子方程式是________________。
(4)證明FeBr2與Cl2發生了氧化還原反應的實驗方法是__________(填操作方法)。
某研究性學習小組用剛吸收過少量SO2的NaOH溶液吸收處理上述實驗后的尾氣。經分析吸收尾氣一段時間后,吸收液(呈強堿性)中肯定存在Cl-、OH-、CO32—和SO42—,對于可能存在的其他陰離子,研究小組提出以下3種假設。假設1:只存在SO32—;假設2:只存在ClO-;假設3:既不存在SO32—,也不存在ClO-。
(5)學習小組判斷同時存在SO32—和ClO-是不可能的理由是_____________________。
(6)現限選以下試劑,設計實驗方案,進行實驗,請寫出實驗步驟以及預期現象和結論。
a.3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液 d.淀粉碘化鉀溶液
e.酚酞試液
步驟一:取少量吸收液于試管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后將所得溶液分裝于A、B兩試管中。
步驟二:向A試管中滴加少量__________(填序號),若溶液____________________(填現象),則假設1成立。
步驟三:向B試管中滴加少量__________(填序號),若溶液____________________(填現象),則假設2成立。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題十一常見金屬元素練習卷(解析版) 題型:選擇題
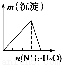
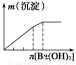
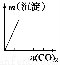
下列實驗與對應示意圖的關系正確的是( )
ABCD
NaAlO2溶液中逐滴滴加鹽酸至過量AlCl3溶液中逐滴滴加氨水至過量 明礬溶液中逐滴滴加Ba(OH)2溶液至過量 澄清石灰水中緩慢通入CO2至過量
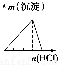
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題十一常見金屬元素練習卷(解析版) 題型:選擇題
工業上冶煉金屬一般用熱分解法、熱還原法和電解法,不同的金屬應選用不同的冶煉方法。選擇的原則主要是依據( )
A.金屬在地殼中的豐度
B.金屬在自然界中的存在形式
C.金屬的還原性強弱
D.金屬的利用價值
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題六物質結構和元素周期律練習卷(解析版) 題型:選擇題
某礦石由前20號元素中的4種組成,其化學式為WmYnZpXq。X、Y、Z、W分布在三個周期,原子序數依次增大,W、Y為金屬元素,X原子的最外層電子數是次外層電子數的3倍,W單質能與冷水劇烈反應,Y、Z原子的最外層電子數之和與X、W原子的最外層電子數之和相等,Y、Z位于同周期,Z單質是一種良好的半導體。下列說法正確的是( )
A.氣態氫化物的穩定性:X<Z
B.含有1 mol Y的氯化物的水溶液中離子總數為4 mol(不考慮水的電離)
C.W位于第三周期ⅠA族,其原子半徑比其他元素的都大
D.2 mol W單質和1 mol Y單質投入足量的水中會產生2.5 mol氣體
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題八電化學練習卷(解析版) 題型:填空題
海洋資源的開發與利用具有廣闊的前景。海水的pH一般在7.5~8.6之間。某地海水中主要離子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)電滲析法是近年發展起來的一種較好的海水淡化技術,其原理如下圖所示。其中陰(陽)離子交換膜只允許陰(陽)離子通過。
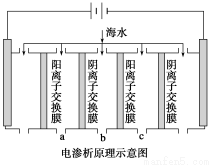
①陰極的電極反應式為__________________。
②電解一段時間,陰極區會產生水垢,其成分為CaCO3和Mg(OH)2,寫出生成CaCO3的離子方程式______________________________________。
③淡水的出口為a、b、c中的________出口。
(2)海水中鋰元素儲量非常豐富,從海水中提取鋰的研究極具潛力。鋰是制造化學電源的重要原料,如LiFePO4電池某電極的工作原理如下圖所示:
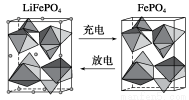
該電池電解質為傳導Li+的固體材料。放電時該電極是電池的________極(填“正”或“負”),電極反應式為______________________。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題五離子反應練習卷(解析版) 題型:選擇題
水溶液中能大量共存的一組離子是( )
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:選擇題
一定量的銅和濃硫酸在加熱條件下充分反應,向反應后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反應后的溶液呈中性,則下列敘述錯誤的是( )
A.溶液中c(Na+)=2c(SO42-)
B.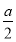 mol>沉淀的物質的量>0
mol>沉淀的物質的量>0
C.沉淀的物質的量=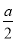 mol
mol
D.原濃硫酸中H2SO4的物質的量>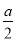 mol
mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com