
【題目】高爐煉鐵過程中發生的主要反應為:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)。已知該反應在不同溫度下的平衡常數如下:
Fe(s)+CO2(g)。已知該反應在不同溫度下的平衡常數如下:
溫度/℃ | 1000 | 1150 | 1300 |
平衡常數 | 4.0 | 3.7 | 3.5 |
請回答下列問題:
(1)該反應的平衡常數表達式K=________,該反應是_________反應(填“放熱”或“吸熱”)。
(2)在一個容積為10L的密閉容器中,1000℃時加入Fe2O3、CO各4.0 mol,反應經過20min后達到平衡。求該時間范圍內反應的平均反應速率v(CO)=__________、CO的平衡轉化率=__________。
(3)欲提高(2)中CO的平衡轉化率,可采取的措施是________
A.降低反應溫度 B.增加Fe2O3的量 C.加入合適的催化劑 D.移出部分CO2 E.減小容器的容積
(4)在1L的密閉容器中,1150℃條件,下列達平衡狀態的是__________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.037 | 0.050 |
【答案】![]() 放熱 0.016mol/(Lmin) 80% AD C
放熱 0.016mol/(Lmin) 80% AD C
【解析】
(1)反應![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)的平衡常數
Fe(s)+CO2(g)的平衡常數![]() ;由表中數據可知,溫度越高平衡常數越小,故升高溫度平衡向逆反應移動,正反應為放熱反應;
;由表中數據可知,溫度越高平衡常數越小,故升高溫度平衡向逆反應移動,正反應為放熱反應;
(2)令平衡時CO的物質的量變化為nmol,則:
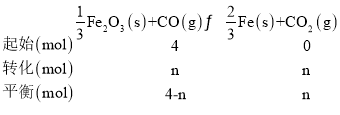
![]() ,解得n=3.2,所以
,解得n=3.2,所以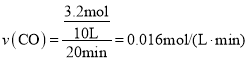 ,CO的平衡轉化率為
,CO的平衡轉化率為![]() ;
;
(3)A.降低反應溫度,平衡將正向移動,可提高CO的平衡轉化率,故A符合題意;
B.氧化鐵是固體,增加Fe2O3的量,不影響平衡移動,CO的平衡轉化率不變,故B不符合題意;
C.加入合適的催化劑,平衡不移動,故C不符合題意;
D.移出部分CO2,平衡向正反應移動,CO的平衡轉化率增大,故D符合題意;
E.反應前后氣體的物質的量不變,減小容器的容積,增大壓強平衡不移動,CO的平衡轉化率不變,故E不符合題意;
故答案為:AD;
(4)1150℃下,平衡常數K=3.7;
A.濃度商![]() ,反應未達到平衡狀態,故A不符合;
,反應未達到平衡狀態,故A不符合;
B.濃度商![]() ,反應未達到平衡狀態,故B不符合;
,反應未達到平衡狀態,故B不符合;
C.濃度商![]() ,反應達到平衡狀態,故C符合;
,反應達到平衡狀態,故C符合;
D.濃度商![]() ,反應未達到平衡狀態,故D不符合;
,反應未達到平衡狀態,故D不符合;
故答案為:C。


 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:高中化學 來源: 題型:
【題目】已知:含C=C的物質(烯烴)一定條件下能與水發生加成反應,生成醇(含羥基的烴的衍生物);有機物A-D間存在圖示的轉化關系。下列說法不正確的是
![]()
A.D結構簡式為CH3COOCH2CH3B.A能使酸性高錳酸鉀溶液褪色
C.B與乙酸發生了取代反應D.可用B萃取碘水中的碘單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2mol金屬鈉和1mol氯氣反應的能量關系如圖所示,下列說法不正確的是( )
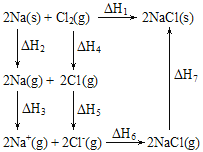
A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值數值上和Cl-Cl共價鍵的鍵能相等
C.ΔH7<0,且該過程形成了分子間作用力
D.ΔH5<0,在相同條件下,2Br(g)的ΔH5′>ΔH5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用 NA 表示阿伏加德羅常數,下列說法中正確的是
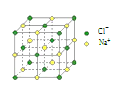
A.1 L 1 mol·L-1 的醋酸溶液中 H+的數目為 NA
B.4 mol NaCl 晶體中含有右圖所示的結構單元的數目為 NA
C.71 g Cl2 通入水中,HClO、Cl-兩種粒子數目總和為 2NA
D.標準狀況下,22.4 L CHCl3 和 CCl4 的混合物所含有分子數目為 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上電解 NaHSO4 溶液制備 Na2S2O8(其中陰離子結構為![]() )。其中陰極材料為 Pb;陽極材料為鉑。下列說法不正確的是
)。其中陰極材料為 Pb;陽極材料為鉑。下列說法不正確的是
A.SO42-向陽極遷移
B.陽極可換為銅電極
C.陽極反應中 S 的化合價不變
D.陰極電極反應式:2H++2e-=H2↑。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在恒容密閉容器中進行反應3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)不能表示上述反應達到化學平衡狀態的是( )
Si3N4(s)+12HCl(g)不能表示上述反應達到化學平衡狀態的是( )
A.v逆(N2)=3v正(H2)
B.N2和HCl物質的量之比保持不變
C.混合氣體密度保持不變
D.每消耗3molSiCl4(g)的同時消耗1molSi3N4(s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列給定條件的溶液中,一定能大量共存的離子組是( )
A.使pH試紙顯深藍色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室溫下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能與金屬鋁反應放出氫氣的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是一個巨大的資源寶庫,海水開發利用的部分過程如圖所示。下列有關說法不正確的是( )
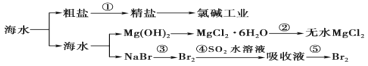
A.①粗鹽制精鹽除采用過濾泥沙外,還必須除去 Ca2+、Mg2+、SO42-等雜質
B.工業生產中常選用石灰乳作為 Mg2+的沉淀劑,并對沉淀進行洗滌
C.第②步的反應是將 MgCl26H2O 晶體在空氣中直接加熱脫去結晶水得無水 MgCl2
D.第③步到第⑤步空氣吹出法提取海水中溴通常使用 SO2 作還原劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com