
分析 由6HCl+2Al=2AlCl3+3H2↑和2NaOH+2Al+2H2O=2NaAlO2+3H2↑進行討論,由反應可知①若Al在兩個反應中均不足量,則生成的H2的物質的量之比為1:1,不符合題意;②若HCl、NaOH在反應中,由HCl、NaOH不足量且物質的量均為0.1mol,則生成的H2的物質的量之比為1:3,不符合題意;由以上兩種情形可以分析得③反應中HCl不足量,NaOH過量,根據反應方程式可以求算出鋁的質量.
解答 解:由6HCl+2Al=2AlCl3+3H2↑和2NaOH+2Al+2H2O=2NaAlO2+3H2↑
①若Al在兩個反應中均不足量,則生成的H2的物質的量之比為1:1,不符合題意;
②若HCl、NaOH在反應中,由HCl、NaOH不足量且物質的量均為0.1mol,則生成的H2的物質的量之比為1:3,不符合題意;
兩份等質量的Al都完全反應且生成H2的體積比為1:2可知③反應中HCl不足量,NaOH過量,
因為鹽酸不足量根據反應6HCl+2Al=2AlCl3 +3H2↑可以得到生成H2的物質的量為0.05mol,
0.1L×1.0mol/L
則Al和 NaOH 反應時應生成H2的物質的量為 0.1mol,因在 2NaOH+2Al+2H2O=2NaAlO2+3H2↑反應中Al不足量可以推出Al的物質的量為$\frac{0.2}{3}$mol,Al的質量為$\frac{0.2}{3}$mol×27g/mol=1.8g,故答案為1.8g.
點評 本題考查鋁與酸和堿反應生成氫氣,根據產生氫氣的體積之比,來進行過量問題的判斷,然后根據不足來求解分析,比較難.


科目:高中化學 來源: 題型:實驗題
| 實驗方案 | 實驗現象 |
| 1.用砂紙擦后的鎂帶與沸水反應,再向反應液中滴加酚酞 2.向新制的H2S飽和溶液中滴加新制的氯水 3.鈉與滴有酚酞試液的冷水反應 4.鎂帶與2mol/L的鹽酸反應 5.鋁條與2mol/L的鹽酸反應 6.向AlCl3溶液中滴加NaOH溶液至過量 | A.浮于水面,熔成小球,四處游動,逐漸縮小,溶液變紅色 B.產生大量氣體,氣體可燃,溶液變淺紅色 C.反應不十分強烈,產生的氣體可燃 D.劇烈反應,產生的氣體可燃 E.生成白色絮狀沉淀,繼而沉淀消失 F.生成淡黃色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數是212 | B. | 中子數是130 | C. | 電子數是194 | D. | 質量數是82 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
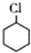 (一氯環己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯環己烷)$→_{II}^{NaOH,乙醇,△}$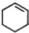 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$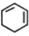
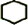
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
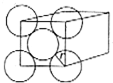 金晶體是面心立方最密堆積,立方體的每個面上5個金原子緊密堆砌(如圖,其余各面省略),金原子半徑為A cm,求:
金晶體是面心立方最密堆積,立方體的每個面上5個金原子緊密堆砌(如圖,其余各面省略),金原子半徑為A cm,求:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
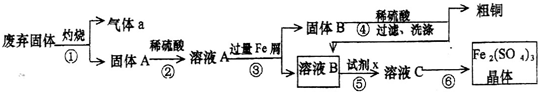
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com