
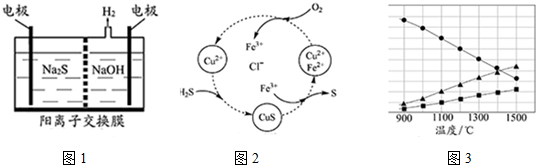
分析 (1)①陰極上氫離子放電生成氫氣,陽極上硫離子放電,電極反應式為S2--2e-═S;
②Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應,同時S元素得電子生成H2S;
(2)①根據圖中各元素化合價變化分析,該反應中S元素化合價由-2價變為0價、O元素化合價由0價變為-2價;
②根據氧化還原反應中得失電子相等計算;
③使生成的硫單質中不含CuS,則硫離子不能有剩余,硫離子完全被氧化為硫單質;
(3)根據題意知,該反應是可逆反應,反應物是硫化氫,根據圖象知,生成物中含有S元素的物質是氫氣的一半,則生成物是S2和H2,再結合反應條件書寫方程式.
解答 解:(1)①陽極上硫離子放電,電極反應式為S2--2e-═S,陰極上氫離子放電生成氫氣,電極反應式為2H++2e-=H2↑,
故答案為:2H++2e-=H2↑;
②電解后陽極區離子為Sn2-,酸性條件下,Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應生成S單質,同時S元素得電子生成H2S,反應方程式為Sn2-+2H+=(n-1)S↓+H2S↑,
故答案為:Sn2-+2H+=(n-1)S↓+H2S↑;
(2)①根據圖中各元素化合價知,Cu元素化合價都是+2價、H元素化合價都是+1價、Cl元素化合價都是-1價,所以化合價不變的是Cu、H、Cl元素,
故答案為:Cu、H、Cl;
②H2S不穩定,易被氧氣氧化生成S單質,反應方程式為2H2S+O2=2S+2H2O,該反應中S元素化合價由-2價變為0價、O元素化合價由0價變為-2價,根據氧化還原反應中得失電子相等得,反應中當有1mol H2S轉化為硫單質時,保持溶液中Fe3+的物質的量不變,消耗O2的物質的量=$\frac{1mol}{2}$=0.5mol,
故答案為:0.5mol;
③使生成的硫單質中不含CuS,則硫離子不能有剩余,硫離子完全被氧化為硫單質,所以氧氣必須過量,采取的措施是:增大混合氣體中空氣的比例;
故答案為:增大混合氣體中空氣的比例;
(3)根據題意知,該反應是可逆反應,反應物是硫化氫,根據圖象知,生成物中含有S元素的物質是氫氣的一半,則生成物是S2和H2,所以該反應方程式為2H2S$\stackrel{高溫}{?}$2H2+S2,
故答案為:2H2S$\stackrel{高溫}{?}$2H2+S2.
點評 本題以S及其化合物的性質為載體考查了電解原理的應用、氧化還原反應,圖象分析判斷等知識點,會正確分析圖象中各個物理量的含義是解本題關鍵,再結合氧化還原反應中各個物理量之間的關系,化學方程式書寫等有關知識來分析解答即可,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | “氯堿法”的副產品為氫氣 | B. | “鋁熱法”常用于冶煉鐵 | ||
| C. | “空氣吹出法”用于海水中提取碘 | D. | “侯氏制堿法”制得的是火堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用漏斗過濾,去除鹽水中的CaCO3 | B. | 用飽和食鹽水洗去Cl2中少量的HCl | ||
| C. | 用CCl4萃取碘水中的碘 | D. | 用升華法除去NaCl中混有的少量碘 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com