
 某化學學習小組的研究課題是:探究測定草酸晶體(H2C2O4•xH2O)中x的值.該組同學通過查閱資料查尋得,草酸易溶于水,水溶液可以用酸性KMnO4溶液進行滴定:
某化學學習小組的研究課題是:探究測定草酸晶體(H2C2O4•xH2O)中x的值.該組同學通過查閱資料查尋得,草酸易溶于水,水溶液可以用酸性KMnO4溶液進行滴定:分析 (1)配制100.00mL溶液時,需要的玻璃儀器有燒杯、玻璃棒、100mL容量瓶、膠頭滴管;
(2)酸性溶液盛放在酸式滴定管中,堿性溶液盛放在堿性滴定管中;
酸性高錳酸鉀溶液呈紫色,草酸和酸性高錳酸鉀溶液發生氧化還原反應而使酸性高錳酸鉀溶液褪色;
(3)由題給化學方程式:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O及數據可知,1.260g純草酸晶體中含H2C2O4的物質的量為:0.1000 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100mL}{25mL}$=0.0100 mol,則1.260gH2C2O4•xH2O中含H2O的物質的量為$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.020 0 mol,根據草酸和水的物質的量之比確定x值;
(4)根據c(待測)=$\frac{c(標準).V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差,從而判斷對測得的x值的影響.
解答 解:(1)配制100.00mL溶液時,需要的玻璃儀器有燒杯、玻璃棒、100mL容量瓶、膠頭滴管,所以還需要的儀器是100mL容量瓶,故答案為:100mL容量瓶;
(2)酸性高錳酸鉀溶液呈酸性,應該用酸式滴定管甲盛放;酸性高錳酸鉀溶液呈紫色,草酸和酸性高錳酸鉀溶液發生氧化還原反應而使酸性高錳酸鉀溶液褪色,則終點現象為當滴入最后一滴酸性KMnO4溶液時,溶液由無色變為淺紫色,且半分鐘內不褪色,
故答案為:甲;當滴入最后一滴酸性KMnO4溶液時,溶液由無色變為淺紫色,且半分鐘內不褪色;
(3)由題給化學方程式:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O及數據可知,1.260g純草酸晶體中含H2C2O4的物質的量為:0.1000 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100mL}{25mL}$=0.0100 mol,則1.260gH2C2O4•xH2O中含H2O的物質的量為$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.020 0 mol,草酸和水的物質的量之比等于其計量數之比=0.0100mol:0.0200mol=1:2,所以x=2,
故答案為:2;
(4)①若滴定終點時俯視滴定管刻度,造成V(標準)偏小,根據c(待測)=$\frac{c(標準).V(標準)}{V(待測)}$知,c(待測)偏小,由此所得n(H2C2O4)偏小,則n(H2O)偏大,x偏大,
故答案為:偏大;
②若滴定時所用的KMnO4溶液因久置而導致濃度變小,造成V(標準)偏大,根據c(待測)=$\frac{c(標準).V(標準)}{V(待測)}$知,c(待測)偏大,由此所得n(H2C2O4)偏大,則n(H2O)偏小,x偏小,
故答案為:偏小.
點評 本題以滴定實驗為載體考查物質組成,側重考查學生實驗操作、實驗分析及判斷能力,明確實驗原理、實驗操作規范性和方法是解本題關鍵,難點是誤差分析,注意量筒和滴定管俯視時讀數誤差區別,為易錯點,


科目:高中化學 來源: 題型:解答題
 某化學學習小組的同學 依據氧化還原反應:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法測定FeSO4的質量分數,實驗步驟如下:
某化學學習小組的同學 依據氧化還原反應:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法測定FeSO4的質量分數,實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
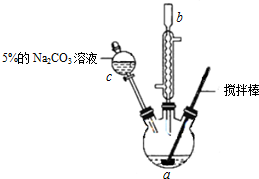
| 密度 | 沸點 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 與水互溶,易溶于有機溶劑 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 與水互溶,易溶于有機溶劑 | 易揮發,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 難溶于水,易溶于有機溶劑 | 易揮發 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
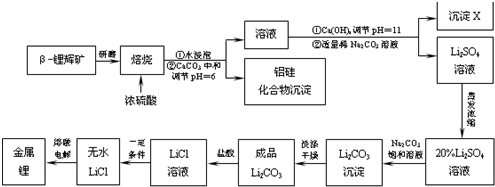
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗 編號 | NaOH溶液的濃度(mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測HCl溶液的體積(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

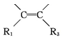 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+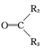
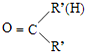 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$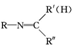 +H2O
+H2O  +HNO3$→_{△}^{濃硫酸}$
+HNO3$→_{△}^{濃硫酸}$ +H2O
+H2O .
. 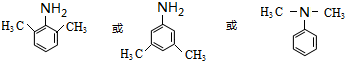 (寫出其中一種的結構簡式).
(寫出其中一種的結構簡式).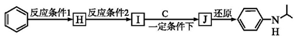 ,
, .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com