
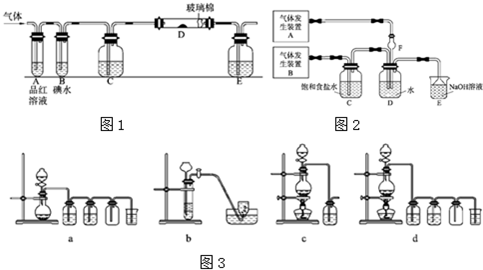
(12分)某興趣小組研究SO2氣體還原Fe3+、I2,他們使用的藥品和裝置如下圖所示:

(1)SO2氣體與Fe3+反應的主要產物是__ __ 。(填離子符號)
(2)下列實驗方案可以用于在實驗室制取所需SO2的是 。
A.Na2SO3溶液與HNO3 B.Na2SO3固體與濃硫酸
C.固體硫在純氧中燃燒 D.銅與熱濃H2SO4
(3)裝置C的作用是 。
(4)如果有280mL SO2氣體(已折算為標態)進入C裝置中,則C中50mL NaOH溶液的物質的量濃度至少為 mol/L才能達到目的。
(5)在上述裝置中通入過量的SO2,為了驗證A中SO2與Fe3+發生了氧化還原反應,他們取A中的溶液,分成三份,并設計了如下實驗:
方案①:往第一份試液中加入KMnO4溶液,紫紅色褪去。
方案②:往第二份試液加入KSCN溶液,不變紅,再加入新制的氯水,溶液變紅。
方案③:往第三份試液加入用稀鹽酸酸化的BaCl2,產生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的還原性弱于SO2的現象是 ,寫出有關離子方程式: 。
(1)SO42-、Fe2+(2分) (2)BD (2分)
(3)吸收多余的SO2,防止污染空氣(1分), (4)0.25 (2分)
(5)方案①(1分)、SO2的水溶液也能使KMnO4溶液褪色(1分)
(6)B中藍色溶液變無色(1分)、I2+SO2+2H2O=2I-+SO42-+4H+ (2分)
【解析】
試題分析:(1)SO2具有還原性,鐵離子具有氧化性,二者發生氧化還原反應,即2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2氣體還原Fe3+反應的產物是Fe2+,SO42-。
(2)A、硝酸具有強氧化性,把亞硫酸鈉氧化成硫酸鈉,得不到二氧化硫,故A錯;B、濃硫酸雖具有強氧化性,但不能氧化亞硫酸鈉,能和亞硫酸鈉反應生成SO2,故B正確;C、固體硫在純氧中燃燒,操作不容易控制,故C錯;D、銅與濃硫酸反應的離子方程式為Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O,所以可以制備SO2,故D正確,因此選BD。
CuSO4+SO2↑+2H2O,所以可以制備SO2,故D正確,因此選BD。
(3)二氧化硫是酸性氧化物具有刺激性氣味,屬于大氣污染物,直接排放污染大氣,能和堿反應生成鹽和水,所以可用堿液吸收二氧化硫,防止污染空氣。
(4)280mL SO2氣體(已折算為標態)物質的量=0.28L÷22.4L/mol=0.0125mol,SO2是酸性氧化物,進入C裝置中發生反應為SO2+NaOH=NaHSO3,則C中消耗氫氧化鈉物質的量為0.0125mol,50mL NaOH溶液的濃度至少=0.0125mol÷0.05L=0.25mol/L。
(5)二氧化硫有還原性,高錳酸鉀有強氧化性,二氧化硫能與高錳酸鉀發生氧化還原反應使高錳酸鉀溶液褪色,而Fe2+也使高錳酸鉀溶液褪色,因此方案①不合理。
(6)二氧化硫能使含有碘的淀粉溶液褪色,說明發生了氧化還原反應,碘是氧化劑,二氧化硫是還原劑,還原劑的還原性大于還原產物的還原性,據此能表明I—的還原性弱于SO2的還原性,反應的離子方程式為I2+SO2+2H2O=2HI+H2SO4。
考點:考查SO2制備以及性質的實驗探究、實驗方案設計與評價、氧化還原反應的應用等


科目:高中化學 來源: 題型:閱讀理解
| 催化劑 |
| 加熱 |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| 反應時間/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
| 測定時間/h | 0 | 1 | 2 | 3 | 4 |
| 雨水樣品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源:2012-2013學年天津市五區縣高三質量檢查試卷(一)理綜化學試卷(解析版) 題型:實驗題
SO2是一種重要的化工原料,也是引起酸雨污染的重要來源。
(1)某興趣小組采用如圖所示裝置制取SO2

①下列實驗方案適用如圖所示裝置制取所需SO2的試劑是_______(填序號)。
A.Na2SO3溶液與稀硝酸
B.Na2SO3固體與濃硫酸
C.固體硫和氧氣
D.銅與濃硫酸
②a的儀器名稱是_______。
③尾氣吸收裝置的連接順序是b接( )接 ( )接e。
(2)為了回收利用SO2廢氣,研究人員研制了利用低品位軟錳礦漿(主要成分是MnO2)吸收高溫焙燒含硫廢渣產生的SO2廢氣,制備硫酸錳晶體( 生產流程,其流程示意圖如下:
生產流程,其流程示意圖如下:

已知:浸出液的pH<2,其中的金屬離子主要是Mn2+,還含有少量的Fe2+、Al3+等其他金屬離子。有關金屬離子形成氫氧化物沉淀時溶液的pH見下表:

請回答:
①含Al3+的鹽常用作凈水劑,用離子方程式表示其凈水原理________________________。
②浸出過程中主要反應的化學方程式是___________________________________________。
③氧化過程中加入MnO2粉的目的是______________________________________________;
反應的離子方程式是_________________________________________________________。
④用石灰漿調節pH,pH應調節的范圍是___________________________________。
⑤濾渣的主要成分是____________________________________。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江西省南昌市高三第三次模擬考試理綜化學試卷(解析版) 題型:實驗題
某興趣小組研究SO2氣體還原Fe3+、I2,他們使用的藥品和裝置如下圖所示:

(1)SO2氣體與Fe3+反應的主要產物是____、 。(填離子符號)
(2)下列實驗方案可以用于在實驗室制取所需SO2的是 。
A.Na2SO3溶液與HNO3 B.Na2SO3固體與濃硫酸
C.固體硫在純氧中燃燒 D.銅與熱濃H2SO4
(3)裝置C的作用是 。
(4)如果有280mL SO2氣體(已折算為標態)進入C裝置中,則C中,50mL NaOH溶液的濃度至少為 mol/L才能達到目的。
(5)在上述裝置中通入過量的SO2為了驗證A中SO2與Fe3+發生了氧化還原反應,他們取A中的溶液,分成三份,并設計了如下實驗:
方案①:往第一份試液中加入KMnO4溶液,紫紅色褪去。
方案②:往第一份試液加入KSCN溶液,不變紅,再加入新制的氯水,溶液變紅。
方案③:往第二份試液加入用稀鹽酸酸化的BaCl2,產生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的還原性弱于SO2的現象是 ,寫出有關離子方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com