
【題目】(12分)溴苯是一種常用的化工原料,通常以苯和溴為原料制取,查資料知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
實驗室制備溴苯的實驗步驟如下:
步驟1:在a中加入15 mL苯和少量鐵屑,再將b中4.0 mL液溴慢慢加入到a中。
步驟2:充分反應后,向a中加入10 mL水,然后過濾除去未反應的鐵屑。
步驟3:濾液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗滌,分液得粗溴苯。
步驟4:向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾即得粗產品。

(1)步驟1儀器a中發生的主要化學反應方程式為: 。
(2)儀器c的作用是冷凝回流,回流的主要物質有: 。
(3)步驟3中NaOH所發生的主要反應是: 。
(4)若將圖1虛線框部分改為圖2裝置,則 D、E可以檢驗出來的物質是 ,其中試管C中苯的作用是 ,能否據此判斷發生了取代反應? (填“是”或“否”)。
【答案】(1)![]() ;(2)苯、溴單質;
;(2)苯、溴單質;
(3)2NaOH+Br2=NaBr+NaBrO+H2O;(4)HBr,吸收溴蒸氣,是。
【解析】
試題分析:(1)鐵作催化劑苯與溴發生取代反應,反應方程式:![]() ;(2)根據上述資料得知,苯和液溴都是易揮發物質,苯和溴反應是放熱反應,使部分苯和溴揮發,冷凝回流物質主要有苯、溴單質;(3)濾液中有溴苯和溶解在里面的溴單質,加入NaOH溶液,發生的反應的是:2NaOH+Br2=NaBr+NaBrO+H2O;(4)揮發出來的氣體有溴蒸氣、溴化氫氣體,C中的苯作用除去揮發出來的溴蒸氣(溴易溶于有機溶劑),D作用驗證溴化氫,溴化氫使石蕊試液變紅,E作用同樣驗證溴化氫,生成淡黃色沉淀,F作用除去多余的溴化氫,加成反應只能生成一種物質,故能判斷發生的是取代反應。
;(2)根據上述資料得知,苯和液溴都是易揮發物質,苯和溴反應是放熱反應,使部分苯和溴揮發,冷凝回流物質主要有苯、溴單質;(3)濾液中有溴苯和溶解在里面的溴單質,加入NaOH溶液,發生的反應的是:2NaOH+Br2=NaBr+NaBrO+H2O;(4)揮發出來的氣體有溴蒸氣、溴化氫氣體,C中的苯作用除去揮發出來的溴蒸氣(溴易溶于有機溶劑),D作用驗證溴化氫,溴化氫使石蕊試液變紅,E作用同樣驗證溴化氫,生成淡黃色沉淀,F作用除去多余的溴化氫,加成反應只能生成一種物質,故能判斷發生的是取代反應。


科目:高中化學 來源: 題型:
【題目】下表1是常溫下幾種弱酸的電離平衡上述(Ka)和弱堿的電離平衡常數(Kb),表2時常溫下幾種難(微)溶物的溶度積常數(Kap)
表1 | |
酸或堿 | 電離常數(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
表2 | |
難(微)溶物 | 溶度積常數(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
請回答下面問題:
(1)上述四種酸中,酸性最強的是______________(用化學式表示)。下列能使醋酸溶液中CH3COOH的電離度增大,而電離常數不變的操作是______(填序號)。
A.升高溫度 B.加水稀釋 C.加少量的CH3COONa固體 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(選填“酸性”、“中性”、“堿性”),寫出HCOONH4水解的離子反應方程式____________。
(3)物質的量1:1的NaCN和HCN的混合溶液,其pH>7,該溶液中離子的濃度從大到小排列為___。
(4)工業中常將BaSO4轉化為BaCO3后,再將其制成各種可溶性的鋇鹽(如:BaCl2)。具體做法是用飽和的純堿溶液浸泡BaSO4粉末,并不斷補充純堿,最后BaSO4轉化為BaCO3。現有足量的BaSO4懸濁液,在該懸濁液中加純堿粉末并不斷攪拌,最終 SO42-物質的量濃度達到0.05mol·L-1,則此時溶液中CO32-物質的量濃度應_____________mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵塊的主要成分是MgCl2,此外還含有Fe3+、Fe2+和Mn2+等離子。若以它為原料按下圖所示工藝流程進行生產,可制得輕質氧化鎂。
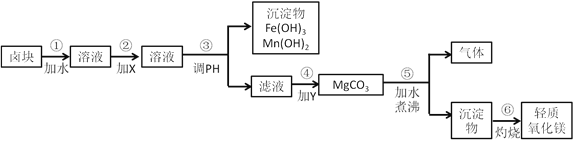
要求產品盡量不含雜質,而且生產成本較低,請根據表中提供的資料,回答下列問題。

(1)在步驟②中加入的試劑X,最佳的選擇是______,其作用是__________;
(2)在步驟④中加入的試劑Y是_______________________;
(3)在步驟⑤中發生反應的化學方程式是_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩種氣態烴組成的混合氣體0.1mol,完全燃燒得0.2molCO2和2.7gH2O,下列說法正確的是( )
A. 混合氣體中一定有甲烷B. 混合氣體可能是甲烷和乙烯
C. 混合氣體中一定有乙烷D. 混合氣體可能是乙烯和乙炔
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaNO2可用作食品添加劑。NaNO2能發生以下反應:
3NO2-+2H+=NO3-+2NO↑+H2O NO2-+Ag+=AgNO2↓(淡黃色)
某化學興趣小組進行以下探究。回答有關問題:
(l)制取NaNO2
反應原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2
Na2CO3+NO+ NO2=2NaNO2+CO2
用下圖所示裝置進行實驗。

① 銅與濃硝酸反應的化學方程式為___________。
② 實驗過程中,需控制B中溶液的pH>7,否則產率會下降,理由是________。
③ 往C中通入空氣的目的是_______________(用化學方程式表示)。
④ 反應結束后,B中溶液經蒸發濃縮、冷卻結品、______等操作,可得到粗產品晶體和母液。
(2)測定粗產品中NaNO2的含量
稱取mg粗產品,溶解后稀釋至250mL。取出25.00 mL溶液,用cmol/LKMNO4酸性溶液平行滴定三次,平均消耗的體積為VmL。
已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
① 稀釋溶液時,需使用的玻璃儀器除燒杯、玻璃棒外,還有______ (填標號)。
A.容量瓶 B.量筒 C.膠頭滴管 D.錐形瓶
② 當觀察到_______時,滴定達到終點。
③ 粗產品中NaNO2的質量分數為________(用代數式表示)。
(3)設計實驗方案證明母液中含有NO2-_____________(限選用的試劑:硝酸、硝酸銀溶液、硝酸鋇溶液、氯化鋇溶液)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將銅鋅合金溶解后與足量KI溶液反應(Zn2+不與I-反應),生成的I2用Na2S2O3標準溶液滴定,根據消耗的Na2S2O3溶液體積可測算合金中銅的含量。實驗過程如下圖所示:

回答下列問題:
(1)H2O2的電子式為_________;“溶解”后銅元素的主要存在形式是______(填離子符號)。
(2)“煮沸”的目的是除去過量的H2O2。298K時,液態過氧化氫分解,每生成0.01molO2放出熱量1.96kJ,該反應的熱化學方程式為_______________。
(3)用緩沖溶液“調PH”是為了避免溶液的酸性太強,否則“滴定”時發生反應:
S2O32-+2H+=S↓+SO2↑+H2O
① 該緩沖溶液是濃度均為0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃時,溶液中各種離子濃度由大到小的順序為_________。
[已知:25℃時,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液發生上述反應時,20s后生成的SO2比S多3.2g,則v(Na2S2O3)=_____mol/(L·s)(忽略溶液體積變化的影響)。
(4)“沉淀”步驟中有CuI沉淀產生,反應的離子方程式為_____________。
(5)“轉化”步驟中,CuI轉化為CuSCN,CuSCN吸附I2的傾向比CuI更小,使“滴定”誤差減小。沉淀完全轉化后,溶液中c(SCN -):c(I-)≥_______________。
[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情況可能造成測得的銅含量偏高的是______(填標號)。
A. 銅鋅合金中含少量鐵
B. “沉淀”時,I2與I-結合生成I3- :I2+I-=I3-
C. “轉化”后的溶液在空氣中放置太久,沒有及時滴定
D. “滴定”過程中,往錐形瓶內加入少量蒸餾水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應8NH3+3Cl2=N2+6NH4Cl,下列說法正確的是( )
A.N2是還原產物
B.Cl2是氧化劑
C.還原劑與氧化劑物質的量之比是3:2
D.還原產物與氧化產物物質的量之比是1 : 6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,A是制取溴苯的實驗裝置,B、C是改進后的裝置。請仔細分析,對比三個裝置,回答下列問題:


(1)寫出三個裝置中發生反應的主要化學方程式:________________。寫出B中右邊試管中所發生反應的化學方程式:__________________。
(2)裝置A和C均采用了長玻璃導管,其作用是_______、____________。
(3)在實驗B、C裝好儀器及藥品后要使反應開始,應對裝置B進行的操作是________________;應對裝置C進行的操作是_______________________。
(4)裝置B、C較好地解決了A中加裝藥品和使裝置及時密封的矛盾,方便了操作。A裝置中這一問題在實驗中造成的后果是_________________。
(5)B中采用了洗氣瓶吸收裝置,其作用是______________________,反應后洗氣瓶中可能出現的現象是_______________。
(6)B裝置也存在兩個明顯的缺點,使實驗的效果不好或不能正常進行。這兩個缺點是_____________________;_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com