
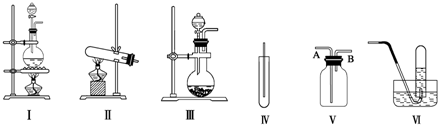
分析 (1)MnO2與濃鹽酸反應制取氯氣,為固體與液體反應且加熱原理,反應生成氯化錳、氯氣、水;
(2)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,為固體與液體反應且不加熱原理;
(3)根據氯氣的性質確定收集方法,注意氯氣有毒,不能使氯氣逸出污染空氣;
(4)利用氯氣的密度選擇排空氣的方法;氯氣的氧化性大于碘的氧化性,碘遇淀粉變藍色.
解答 解:(1)二氧化錳和濃鹽酸的反應是固液混合加熱型,所以選擇Ⅰ裝置;在加熱條件下,二氧化錳和濃鹽酸反應生成氯化錳、氯氣和水,反應為MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案為:Ⅰ;MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)KMnO4與濃鹽酸的反應是固液混合不需要加熱的,所以應選擇Ⅲ裝置,故答案為:Ⅲ;
(3)氯氣有毒,逸出會污染大氣,所以不能讓氯氣逸出;氯氣和水能反應是鹽酸和次氯酸,鹽酸和次氯酸是酸,都能和堿反應,所以可用氫氧化鈉溶液吸收氯氣,
故答案為:氫氧化鈉;防止氯氣逸出污染空氣;
(4)氯氣的密度大于空氣的密度,所以應采用向上排空氣法收集氯氣,故A為進氣口;氯氣的氧化性大于碘的氧化性,所以氯氣能置換出碘化鉀中的碘,且碘遇淀粉變藍色,所以可用濕潤的淀粉KI試紙放在B口處檢驗是否收集滿了氯氣,
故答案為:A;將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿.
點評 本題考查常見氣體的制備實驗及裝置,為高頻考點,把握實驗裝置的作用、氣體的制備原理為解答的關鍵,側重分析與實驗能力的考查,注意實驗基本技能的綜合應用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 將100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒數目為0.0l NA | |
| B. | Na2O2與足量的水反應生成1 molO2,轉移電子數目為2 NA | |
| C. | 某密閉容器中有2mo1SO2和1mol O2,在一定條件下充分反應,轉移的電子數為4 NA | |
| D. | 18g重水(D2O)所含的電子數為1 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2mol | B. | 2.5 mol | C. | 3.5mol | D. | 5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子總數 | B. | 原子總數 | C. | 質量 | D. | 質子總數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.4g Mg變成Mg2+時失去的電子數為0.1 NA | |
| B. | 標準狀況下,11.2 L水所含的原子數為1.5 NA | |
| C. | 在常溫常壓下,32g氧氣所含原子數目為2NA | |
| D. | 0.1mol/LK2SO4溶液含有 K+0.2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | a | b | 試管中現象 | 離子方程式 |
| A | 硫酸 | KI淀粉 | 在空氣中放置一段時間后溶液呈藍色 | 4H++4I-+O2═2I2+2H2O |
| B | 稀鹽酸 | Na2CO3 | 開始時無氣泡,后來有氣泡 | CO32-+H+═HCO3-; HCO3-+H+═H2O+CO2↑ |
| C | 稀鹽酸 | Na2SiO3 | 產生白色膠狀物 | 2H++SiO32-═H2SiO3(膠體) |
| D | 硫酸 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由紅色變為無色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 合成氨的流程示意圖如圖:回答下列問題:
合成氨的流程示意圖如圖:回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com