
【題目】ClO2是一種高效安全滅菌消毒劑。ClO2屬于( )
A.酸B.堿C.鹽D.氧化物
科目:高中化學 來源: 題型:
【題目】甲醇是一種重要的化工原料,又是一種可再生能源,具有開發和應用的廣闊前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g)△H=+84kJmol1
2H2(g)+O2(g)═2H2O(g)△H=484kJmol1
工業上常以甲醇為原料制取甲醛,請寫出CH3OH(g)與O2(g)反應生成HCHO(g)和H2O(g)的熱化學方程式: ________________________________
(2)在一容積為2L的密閉容器內,充入0.2molCO與0.4molH2發生反應CO(g)+2H2(g)CH3OH(g),CO的平衡轉化率與溫度,壓強的關系如圖所示。

①A,B兩點對應的壓強大小關系是PA________PB(填“>,<,=”)
②A,B,C三點的平衡常數KA,KB,KC的大小關系是 __________________
③下列敘述能說明上述反應能達到化學平衡狀態的是___(填代號)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的體積分數不再改變
c.混合氣體的密度不再改變 d.CO和CH3OH的物質的量之和保持不變
(3)在P1壓強、T1°C時,該反應的平衡常數K=_________,再加入1.0molCO后重新到達平衡,則CO的轉化率___________(填“增大,不變或減小”),CH3OH的體積分數_________(填“增大,不變或減小”)
(4)T1°C、1L的密閉容器內發生上述反應,測得某時刻各物質的物質的量如下:CO:0.1mol H2 :0.2mol CH3OH:0.2mol。
此時v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀鹽酸,CO2的生成量與加入鹽酸的體積(V)的關系如圖所示。下列判斷正確的是( )

A. 在0-a范圍內,只發生中和反應
B. ab段發生反應的離子方程式為:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH與Na2CO3的物質的量之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁均為中學化學常見的純凈物,它們之間有如下圖所示的反應關系。下列物質組不滿足上述轉化關系的是
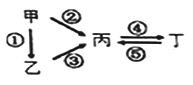
選項 | 甲 | 乙 | 丙 | 丁 |
A | Fe | FeCl2 | FeCl3 | Fe(OH)3 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | Na | Na2O | Na2O2 | NaOH |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如下裝置制取氯氣,并用氯氣進行實驗。回答下列問題:
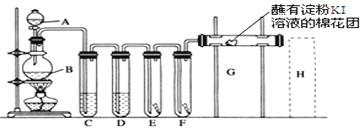
(1)A中盛有濃鹽酸,B中盛有MnO2,寫出反應的離子方程式___________________。
(2)D中放入濃H2SO4其目的是_____________________________。
(3)E中為紅色干布條,F中為紅色濕布條,可觀察到的現象是___________,對比E和F中現象的差異可得出的結論是________________________________。
(4)G處的現象是____________________________________。
(5)用化學方程式寫出H處尾氣吸收裝置中的反應原理____________。
(6)家庭中常用消毒液(主要成分NaClO)與潔廁靈(主要成分鹽酸)清潔衛生。某品牌消毒液包裝上說明如下圖。

①消毒液與潔廁靈不能同時使用,原因是(用離子方程式表示)____________。
②需“密閉保存”的原因____________________________________________。
(7)工業上用亞氯酸鈉和稀鹽酸為原料制備 ClO2 ,寫出反應的化學方程式____________。Cl2和ClO2都是強氧化劑,能殺死水中的病菌。等質量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化學性質和鹵素(X2)很相似,化學上稱為擬鹵素,如:[(SCN)2+H2O = HSCN+HSCNO]。它們陰離子的還原性強弱為 Cl-<Br-<CN-<SCN-<I-。試寫出:KBr和KSCN的混合溶液中加入(CN)2,反應的化學方程式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有五種可溶性物質A、B、C、D、E,它們所含的陰、陽離子互不相同,分別含有五種陽離子Al3+、Fe3+、Cu2+、Ba2+、K+和五種陰離子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一種。
、Xn-(n=1或2)中的一種。
(1)某同學通過比較分析,認為無須檢驗就可判斷其中必有的兩種物質是_____和_____。
(2)物質C中含有離子Xn-。為了確定Xn-,現將(1)中的兩種物質記為A和B,當C與A的溶液混合時產生藍色沉淀,向該沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固體,則X為________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)將38.4 g Cu投入裝有足量D溶液的試管中,Cu不溶解,再滴加稀H2SO4,Cu逐漸溶解,管口附近有紅棕色氣體出現,則物質D一定含有上述離子中的________(填相應的離子符號),寫出Cu溶解的離子方程式____________________________________________,若要將Cu完全溶解,至少加入H2SO4的物質的量是_____________。
(4)E溶液與氫碘酸反應時可生成使淀粉變藍的物質,該反應的離子方程式為___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組的同學為探究和比較SO2和氯水的漂白性,設計了如下的實驗裝置。
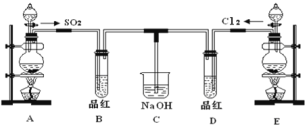
(1)實驗室用裝置E制備Cl2,其反應的離子方程式為__________________________;若有8mol的HCl參加反應,則轉移的電子總數為________。
(2)該裝置中氫氧化鈉溶液的作用是___________________。
(3)通氣后B、D兩個試管中的現象______________。停止通氣后,再給B、D兩個試管分別加熱,兩個試管中的現象分別為B:________,D:________。
(4)另一個實驗小組的同學認為SO2和氯水都有漂白性,二者混合后的漂白性肯定會更強。他們將制得的SO2和Cl2按1:1同時通入到品紅溶液中,結果發現褪色效果并不像想象的那樣。請你分析該現象的原因(用離子方程式表示)____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸亞鐵(FeC2O4·2H2O)可用于制備磷酸鐵鋰電池正極材料。實驗室制備草酸亞鐵并測定其組成的實驗流程如下:

(1) “溶解”時加熱的目的是_____________________;“沉鐵”時將溶液煮沸并在不斷攪拌下加入H2C2O4溶液,“不斷攪拌”除可使反應物充分接觸外,另一目的是_____________________。
(2) “過濾、洗滌”時,能說明沉淀已洗滌干凈的依據是_____________________。
(3)按以下步驟可以測定產品中草酸根的質量分數。
①稱取0.1600g草酸亞鐵于錐形瓶中,加入25mL2mol·L-1的H2SO4溶液,加熱至40~50℃,使樣品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸約10min。
④將濾液過濾至另一個錐形瓶中,用10mL1mol·L-1的H2SO4溶液洗滌錐形瓶,將全部Fe2+轉移入錐形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液體積8.00 mL。
(I)測得的產品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)請計算產品中C2O![]() 的質量分數(寫出計算過程)。______________
的質量分數(寫出計算過程)。______________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com