
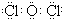 .
.
分析 (1)(2)(3)化合物A由兩種短周期元素組成,氣體A與NH3反應生成離子晶體C、氣體單質D和常見液體E,D為空氣中含量最多的物質,則D為N2,常見液體E為H2O,根據元素守恒可知,A為氯的氧化物,測得A氣體對空氣的相對密度為3.0,則其相對分子質量為3×29=87,故A分子中Cl原子數目為偶數,只能為2,則含有氧原子數目=$\frac{87-35.5×2}{16}$=1,故A為Cl2O,可推知離子化合物C為NH4Cl,A溶于水可得只含單一溶質B的弱酸性溶液,B溶液在放置過程中其酸性會增強,B為HClO,氣體A可用某一氣體單質與潮濕的Na2CO3反應制得,同時生成兩種鈉鹽,由元素守恒可知,該單質氣體為Cl2,生成的兩種鈉鹽只能為NaHCO3、NaCl,據此解答(1)(2)(3);
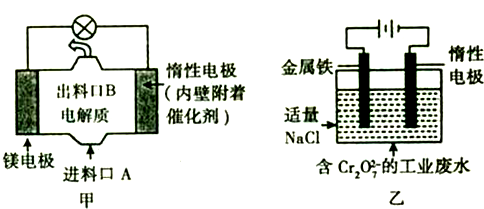
(4)該原電池中,鎂作負極,負極上鎂失電子發生氧化反應,負極反應為Mg-2e-=Mg2+,電池反應式為Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正極上次氯酸根離子得電子發生還原反應,據此書寫電池反應;由電子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此計算.
解答 解:某含氯化合物A由兩種短周期元素組成,氣體A與NH3反應生成離子晶體C、氣體單質D和常見液體E,D為空氣中含量最多的物質,則D為N2,常見液體E為H2O,根據元素守恒可知,A為氯的氧化物,測得A氣體對空氣的相對密度為3.0,則其相對分子質量為3×29=87,故A分子中Cl原子數目為偶數,只能為2,則含有氧原子數目=$\frac{87-35.5×2}{16}$=1,故A為Cl2O,可推知離子化合物C為NH4Cl,A溶于水可得只含單一溶質B的弱酸性溶液,B溶液在放置過程中其酸性會增強,B為HClO,氣體A可用某一氣體單質與潮濕的Na2CO3反應制得,同時生成兩種鈉鹽,由元素守恒可知,該單質氣體為Cl2,生成的兩種鈉鹽只能為NaHCO3、NaCl,
(1)由上述分析可知,氣體A的化學式為Cl2O,A為共價化合物的電子式為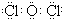
故答案為:Cl2O;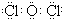 ;
;
(2)氣體A與NH3反應的化學方程式為:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,反應中Cl的化合價降低,該反應體現氣體Cl2O具有氧化性,
故答案為:3Cl2O+10NH3=6NH4Cl+2N2+3H2O;
(3)Cl2與潮濕的碳酸鈉反應生成Cl2O,同時生成的兩種鈉鹽只能為NaHCO3、NaCl,化學方程式為:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,將上述恰好完全反應后生成的兩種鈉鹽NaHCO3、NaCl的混合物溶于水形成溶液顯示堿性,碳酸氫根離子的水解程度大于電離程度,
A.根據物料守恒,得到c(Na+)>2c(HCO3-)+2c(H2CO3)+2c(CO32-),故A錯誤;
B.根據電荷守恒:c(OH-)+c(Cl-)=c(HCO3-)+2c(CO32-)+c(H+),故B錯誤;
C、等量的兩種鈉鹽NaHCO3、NaCl的混合物中,碳酸氫根離子的水解程度大于電離程度,所以c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3)
,故C正確;故答案為:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;C;
(4)該原電池中,鎂作負極,負極上鎂失電子發生氧化反應,負極反應為Mg-2e-=Mg2+,正極上次氯酸根離子得電子發生還原反應Mg+ClO-+H2O=Cl-+Mg(OH)2,電池反應式為兩電極反應之和,即Mg+ClO-+H2O=Mg(OH)2↓+Cl-,甲中的鎂電極是原電池的負極,應該和電源的負極相連,
由電子守恒可知,3Mg~6e-~3Fe2+,Cr2O72-~2Cr3+~2Cr(OH)3↓,則n(Mg)=$\frac{3.6g}{24g/mol}$=0.15mol,消耗金屬鎂0.15mol,轉移電子是0.3mol,此時得到的鉻離子是0.1mol,產生沉淀是0.1mol×103g/mol=10.3g,故答案為:10.3g.
點評 本題考查無機物推斷、原電池的工作原理、氧化還原反應中電子守恒的計算等,側重考查學生對知識的綜合應用及邏輯推理能力,需要學生具備扎實的基礎,難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 互為同系物且一氯代物只有兩種的物質的結構簡式:
互為同系物且一氯代物只有兩種的物質的結構簡式: 或
或 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高錳酸鉀) | D. | 溴苯中的溴(苯) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
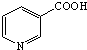 )俗稱煙酸,微溶于水.可作血管擴張類藥物.完成下列填空:
)俗稱煙酸,微溶于水.可作血管擴張類藥物.完成下列填空: .試劑濃硝酸、濃硫酸.
.試劑濃硝酸、濃硫酸.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸和氨水反應 H++OH-=H2O | |
| B. | 鈉和冷水反應 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯氣和氫氧化鈉溶液反應 Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 銅和稀硝酸反應 Cu+2NO3-+4H+=2Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| B. | 相同溫度下,0.6 mol•L-1氨水和0.3 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 向0.1 mol•L-1NaNO3溶液中滴加鹽酸使溶液的pH=5,此時混合液中的c(Na+)=c(NO3-) | |
| D. | 室溫下,0.1 mol•L-1NH4Cl溶液與0.1 mol•L-1氨水等體積混合(pH>7):則c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com