

分析 (1)根據所給的條件反應,結合要求的目標反應,將條件反應調整計量數并做相應的加減得目標反應,反應熱做相應的變化即可;
(2)①反應達平衡的根本標志是V正=V逆,而c點的只是V正最大而已;
②容器恒容絕熱,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反應放熱,若在該容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),則開始反應放熱;若在容器中加入II:1molSO3(g)和1mol NO(g),則開始時反應吸熱,據此分析平衡常數;
(3)通過A室產生了N2,可知A極的電解質溶液為NaNO3和NaNO2的混合溶液,NO2-在A極放電為N2,則A為陰極;則B極為陽極,電解質溶液為NaOH溶液,OH-在B極放電,據此分析;
(4)設出NO的體積為XL,NO2的體積為YL,則有X+Y=6 ①然后根據和氨氣反應時得失電子數守恒可有:2X+4Y=7×3 ②將兩式聯立解答.
解答 解:(1)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 ①
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1 ②
根據蓋斯定律,將$\frac{1}{2}$(①-②)可得:SO2(g)+NO2(g)?NO(g)+SO3 (g)△H=$\frac{1}{2}$[(-196.6kJ•mol-1)-(-113.0kJ•mol-1)]=-41.6KJ/mol,該反應的焓變△H<0,為放熱反應,
故答案為:放熱;
(2)①化學平衡狀態的標志是各物質的濃度不再改變,其實質是正反應速率等于逆反應速率,c點對應的正反應速率顯然還在改變,故一定未達平衡,
故答案為:未達;
②容器恒容絕熱,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反應放熱,若在該容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),則開始反應放熱,溫度升高平衡左移,K減小;若在容器中加入II:1molSO3(g)和1mol NO(g),則開始時反應吸熱,溫度降低平衡右移,K增大,故該反應的平衡常數Ⅰ<Ⅱ,
故答案為:<;
(3)通過A室產生了N2,可知I極的電解質溶液為NaNO3和NaNO2的混合溶液,NO2-在I放電為N2,則A為陰極;則II極為陽極,電解質溶液為NaOH溶液,OH-在II極放電.
①電極I為陰極,由于B室為NaOH溶液,且II極為陽極,故在II極放電的是氫氧根:4OH--4e-=O2↑+2H2O,即產生的氣體為氧氣,
故答案為:陰極;O2;
②NO2-在陰極得電子被還原為氮氣,結合B室的溶液是中性溶液,故放電的方程式為:2NO2-+6e-+6H2O=8OH-+N2↑,
故答案為:2NO2-+6e-+6H2O=8OH-+N2↑;
(4)設出NO的體積為XL,NO2的體積為YL,根據混合氣體的體積為6L,則有X+Y=6 ①
氨氣反應時,NO和NO2得電子,而氨氣失電子,根據得失電子數守恒可有:2X+4Y=7×3 ②
將兩式聯立即可解得X=1.5,Y=4.5,則有X:Y=1:3,
故答案為:1:3.
點評 本題考查較為綜合,涉及本題考查了蓋斯定律的應用、化學平衡常數的大小比較以及電化學知識的運用,注意掌握蓋斯定律的內容、電解原理,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 植物油存放過久,會有一種難聞的“哈喇”味,但不影響食用 | |
| B. | 葡萄糖能發生水解反應 | |
| C. | 淀粉和纖維素水解的最終產物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有兩性,但蛋白質沒有兩性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 麻黃素中含氧官能團的名稱是羥基,屬于醇類(填“醇”或“酚”).
麻黃素中含氧官能團的名稱是羥基,屬于醇類(填“醇”或“酚”).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化工工業中常用乙苯脫氫的方法制備苯乙烯.
化工工業中常用乙苯脫氫的方法制備苯乙烯.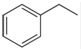 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:解答題
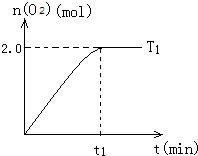 一定溫度下,在2L密閉容器中加入納米級Cu2O并通入10.0mol水蒸氣,發生反應:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1溫度下不同時段產生O2的量,見表:
一定溫度下,在2L密閉容器中加入納米級Cu2O并通入10.0mol水蒸氣,發生反應:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1溫度下不同時段產生O2的量,見表:| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.
2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.| 溫度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

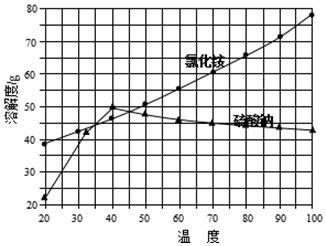
| 操作步驟 | 現象 | 結論 |
| 取少量氯化銨產品于試管底部,加熱 | 如果試管底部沒有固體剩余 | 表明氯化銨產品純凈 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com