
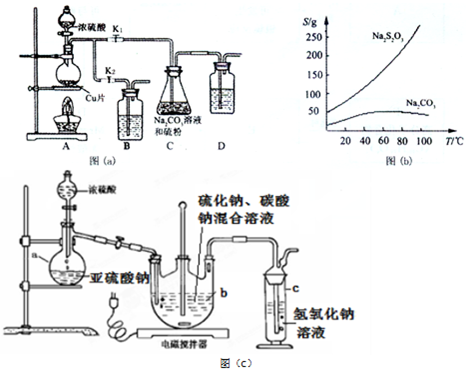
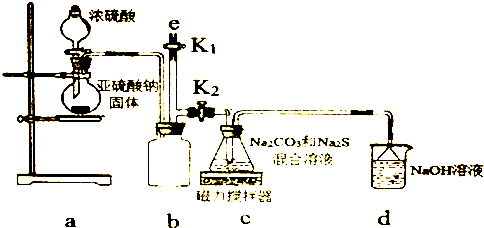
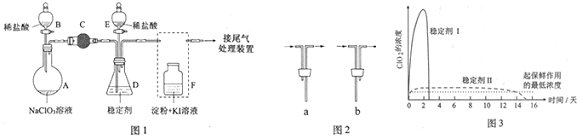
分析 (1)根據裝置圖可知a的裝置名稱;裝置A是制取SO2的裝置,在反應過程中生成的CO2和多余的SO2會從三頸燒瓶中逸出,所以裝置C是尾氣處理裝置;
(2)①步驟1:利用氣體熱脹冷縮性質,檢驗裝置氣密性;
步驟2:銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水;二氧化硫不能排放到空氣中,應有尾氣處理裝置;
步驟3:硫代硫酸鈉在酸性溶液中不穩定,應控制溶液為弱堿性,即控制溶液pH接近或不小于7;
步驟4:從溶液中獲得晶體,需要蒸發濃縮,趁熱過濾,再將濾液冷卻結晶、過濾、洗滌、烘干,得到產品;
②氯水中氯氣和水反應生成鹽酸和次氯酸,氯水中一定有氯離子;
③由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,結合消耗的Na2S2O3利用關系式計算溶液中n(Ba2+),進而計算c(Ba2+).
解答 解:(1)由圖可知a的裝置名稱為蒸餾燒瓶;裝置A是制取SO2的裝置,在反應過程中生成的CO2和多余的SO2會從三頸燒瓶中逸出,所以裝置C是尾氣處理裝置,
故答案為:蒸餾燒瓶;吸收反應生成的CO2和多余的SO2,防止污染空氣;
(2)①步驟1:利用氣體熱脹冷縮性質,檢驗裝置氣密性,具體操作為:關閉K2打開K1,在D中加水淹沒導管末端,用熱毛巾或雙手捂住燒瓶,D中導管有氣泡冒出,冷卻后形成1段水柱,說明氣密性良好,
故答案為:關閉K2打開K1,在D中加水淹沒導管末端,用熱毛巾或雙手捂住燒瓶,D中導管有氣泡冒出,冷卻后形成1段水柱,說明氣密性良好;
步驟2:銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水,反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;SO2是大氣污染物,需要尾氣處理,則裝置B、D中應盛放氫氧化鈉溶液,用來吸收SO2,防止污染環境;Na2S2O3•5H2O受熱易分解,所需冷卻結晶,所以從濾液中獲取Na2S2O3•5H2O需蒸發濃縮冷卻結晶等操作,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;吸收SO2,防止污染;
步驟3:步驟3:由于Na2S2O3在酸性溶液中不能穩定存在,碳酸鈉的作用是起反應物作用及提供堿性環境,
故答案為:Na2S2O3在酸性溶液中不能穩定存在;
步驟4:從溶液中獲得晶體,需要蒸發濃縮,趁熱過濾,再將濾液冷卻結晶、過濾、洗滌、烘干,得到產品,
故答案為:蒸發濃縮;
②因為氯水中氯氣和水反應生成鹽酸和次氯酸,氯水中一定有氯離子,所以加入硝酸銀生成沉淀,不能證明因Na2S2O3具有還原性,氯離子是氯氣做氧化劑生成的,
故答案為:不正確,因為氯水中含有Cl-;
③由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,消耗的Na2S2O3為0.018L×0.01mol/L,則n(Ba2+)=0.018L×0.01mol/L×$\frac{1}{3}$=0.00006mol,故溶液中c(Ba2+)=$\frac{0.00006mol}{0.025L}$=0.0024mol/L,
故答案為:0.0024mol/L.
點評 本題考查了有關硫代硫酸鈉的知識,理解工藝流程,掌握實驗操作與設計及物質性質是解答的關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
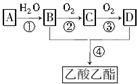 已知:①A是石油裂解氣的主要成分,是一種相對分子質量為28的氣態烴,A的產量通常用來衡量一個國家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.現以A為主要原料合成乙酸乙酯,其合成路線如下:
已知:①A是石油裂解氣的主要成分,是一種相對分子質量為28的氣態烴,A的產量通常用來衡量一個國家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.現以A為主要原料合成乙酸乙酯,其合成路線如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=+890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗 編號 | T/K | 催化劑的 用量/g | KMnO4酸性溶液 的濃度/mol?L-1 | 實驗目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)實驗①和②探究KMnO4酸性溶液的濃度對該反應速率的影響; (Ⅱ)實驗①和③探究溫度對該反應速率的影響; (Ⅲ)實驗①和④探究催化劑對該反應速率的影響 |
| ② | ||||
| ③ | ||||
| ④ |
| KMnO4酸性溶液的濃度/mol.L-1 | 溶液褪色所需時間t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2的摩爾質量是2 g | B. | 1 mol H2O的質量是18 g/mol | ||
| C. | 氧氣的摩爾質量是32 g/mol | D. | 2 g H2含1 mol H |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com