
已知反應X+Y═M+N為放熱反應,對該反應的說法正確是
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的總能量一定高于M和N的總能量
D.因為該反應為放熱反應,故不必加熱就可發生
 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源:2015-2016學年吉林省高二9月檢測化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.石油的分餾和煤的干餾都是物理變化
B.甲烷、苯、乙酸乙酯都可以發生取代反應
C.油脂、蛋白質和纖維素都是高分子化合物
D.在加熱、甲醛、飽和(NH4)2SO4溶液、X射線作用下,蛋白質都會發生變性
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省遵義市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值。下列敘述正確的是
A.8g18O2含有的中子數為5N A
B.1molFeI2與足量Cl2氯氣充分反應轉移的電子數為2NA
C.標準狀況下22.4LNO與11.2LO2混合后的氣體分子數約為NA
D.7.8 g Na2S和Na2O2的混合物中含有的陰離子數等于0.1NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧葫蘆島一中高二上期初考試化學試卷 (解析版) 題型:選擇題
根據碘與氫氣反應的熱化學方程式,下列判斷正確的是
① I2(g)+ H2(g)  2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol
② I2(s)+ H2(g)  2HI(g) △H=+26.48 kJ/mol
2HI(g) △H=+26.48 kJ/mol
A.254g I2(g)中通入2g H2(g),反應放熱9.48 kJ
B.當反應②吸收52.96kJ熱量時轉移2mole一
C.反應②的反應物總能量比反應①的反應物總能量低
D.1 mol固態碘與1 mol氣態碘所含能量相差17.00 kJ
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江大慶鐵人中學高二上9月考化學試卷(解析版) 題型:選擇題
下圖兩個裝置中,液體體積均為200ml,開始時電解質溶液的濃度均為0.1mol/L,工作一段時間后,測得導線上都通過了0.02mole—,若不考慮溶液體積的變化,下列敘述正確的是

A.產生氣體體積①=②
B.電極上析出固體質量①<②
C.電極反應式:①中陽極:4OH-—4e-=2H2O+O2↑②中負極2H++2e-=H2↑
D.溶液的pH變化:①減小②增大
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三9月月考化學試卷(解析版) 題型:填空題
(14分)光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成。
(1)實驗室中常用來制備氯氣的化學方程式為: ;
(2)實驗室中可用氯仿(CHCl3)與雙氧水直接反應制備光氣,其反應的化學方程式為__ ;
(3)COCl2的分解反應為COCl2(g)= Cl2(g)+ CO(g) △H = +108 kJ/mol。反應體系達到平衡后,各物質的濃度在不同條件下的變化狀況如下圖所示(第10 min到14 min的COCl2濃度變化曲線未示出):
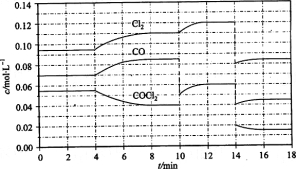
①計算反應在第8 min時的平衡常數K = __________(保留小數點后三位)
②比較第2 min反應溫度T(2)與第8 min反應溫度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min時反應于溫度T(8)下重新達到平衡,則此時c(COCl2)= ______mol/L;
④比較產物CO在2~3 min、5~6 min和12~13 min時平均反應速率[平均反應速率分別以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比較反應物COCl2在5-6 min和15-16 min時平均反應速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三上期中測試化學試卷(解析版) 題型:填空題
【化學—選修2:化學與技術】(10分)生態工業園區的建設,不僅僅是體現環保理念更要依據循環經濟理論和充分考慮經濟的可持續發展。下面是某企業設計的硫酸-磷銨-水泥聯產,海水-淡水多用,鹽-熱-電聯產三大生態產業鏈流程圖。
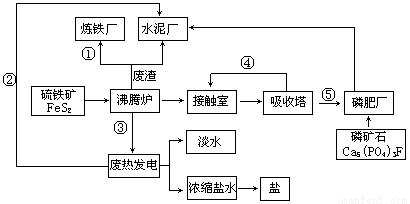
根據上述產業流程回答下列問題:
(1)從原料、能源、交通角度考慮該企業應建在
A.西部山區 B.沿海地區 C.發達城市 D.東北內陸
(2)該流程①、②、③、④、⑤為能量或物質的輸送,請分別寫出輸送的主要物質的化學式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸騰爐發生反應的化學方程式 ,磷肥廠的產品是普鈣,其主要成份是 (填化學式)。
(4)熱電廠的冷卻水是 ,該流程中濃縮鹽水除提取鹽以外還可提取的物質有 (寫出一種即可)。
(5)根據生態園區建設理念請提出高爐煉鐵廠廢氣、廢渣及多余熱能的利用設想 , (請寫出兩點)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧育才學校高一上第一次階段測化學試卷(解析版) 題型:填空題
(7分)實驗室用密度為1.18g/mL,質量分數為36.5%濃鹽酸配制250mL0.1mol/L的鹽酸溶液,填空并請回答下列問題:
(1)配制250mL0.1mol/L的鹽酸溶液
應量取鹽酸體積/mL | 應選用容量瓶的規格/mL |
(2)配制時,其正確的操作順序是(字母表示,每個字母只能用一次) 。
A.用30mL水洗滌燒杯2—3次,洗滌液均注入容量瓶,振蕩
B.用量筒量準確量取所需的濃鹽酸的體積,沿玻璃棒倒入燒杯中,再加入少量水(約30mL),用玻璃棒慢慢攪動,使其混合均勻
C.將已冷卻的鹽酸沿玻璃棒注入250mL的容量瓶中
D.將容量瓶蓋緊,振蕩,搖勻
E.改用膠頭滴管加水,使溶液凹面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度2—3cm處
(3)溶液注入容量瓶前需恢復到室溫,這是因為______________________。
(4)若注入容量瓶前未恢復到室溫,對所配溶液濃度將有何影響? _______________(填“偏低”“偏高”“無影響”)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省高一上期中測試化學試卷(解析版) 題型:填空題
(10分)實驗室配制460mL0.100mol/LNa2CO3溶液回答下列問題,現有下列儀器
A.燒杯 B.100mL量筒 C.500mL容量瓶 D.藥匙 E.玻璃棒 F.天平
(1)配制時,必須使用的儀器有___________________(填代號),還缺少的儀器是________________該試驗中兩次用到玻璃棒,其作用分別是________________,___________________
(2)應用托盤天平稱取十水碳酸鈉晶體的質量為___________________,若加蒸餾水不慎超過刻度線,處理的方法是______________________
(3)若實驗遇下列情況,溶液的濃度是偏高、偏低還是不變.
A.溶解后沒有冷卻便進行定容__________________;
B.搖勻后發現液面低于標線,滴加蒸餾水至標線再搖勻___________________;
C.定容時俯視容量瓶的標線___________________;
D.容量瓶內壁附有水珠而未干燥處理___________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com