
【題目】對于平衡體系:aA(g)+bB(g)![]() cC(g)+dD(g);正反應放熱,有下列判斷,其中正確的是( )
cC(g)+dD(g);正反應放熱,有下列判斷,其中正確的是( )
A.若溫度不變,容器體積擴大一倍,此時A的濃度是原來的0.6倍,則a+b<c+d
B.若從正反應開始,A、B的初始物質的量之比為1:1,則平衡時A、B的轉化率一定相等
C.若平衡體系中共有氣體M mol,再向其中充入b mol B,達到平衡時氣體總物質的量為(M+b)mol,則a+b>c+d
D.若從正反應開始,平衡時A、B的轉化率相等,則投入A、B物質的量之比為a:b
【答案】D
【解析】
A、溫度不變,容器體積擴大一倍,此時A的濃度是原來的0.6倍,說明降低壓強,平衡向逆反應移動,降低壓強平衡向氣體體積增大的方向移動,故a+b>c+d,故A錯誤;
B、若A、B的初始物質的量之比等于其化學計量數之比,則平衡時A、B的轉化率一定相等。A、B的初始物質的量之比為1:1,二者的化學計量數之比不一定是1:1,平衡時轉化率不一定相等,故B錯誤;
C、衡體系中共有氣體M mol,再向其中充入bmolB,平衡向正反應移動,達到平衡時氣體總物質的量為(M+b)mol,混合氣體的總的物質的量不變,故反應前后氣體的化學計量數之和相等,即a+b=c+d,故C錯誤;
D、若從正反應開始,平衡時A、B的轉化率相等,則投入A、B的物質的量之比為a:b,即是物質的量之比等于化學計量數之比,故D正確;
故選D.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】可逆反應N2+3H2![]() 2NH3的正逆反應速率可用各反應物或生成物濃度的變化來表示。下列關系中能說明反應已達到平衡狀態的是( )
2NH3的正逆反應速率可用各反應物或生成物濃度的變化來表示。下列關系中能說明反應已達到平衡狀態的是( )
A.v正(N2)=v逆(NH3)B.3v正(N2)=v正(H2)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反應機理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反應機理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有關該反應的說法正確的是( )
A. 該反應的速率主要取決于①的快慢
B. NOBr2是該反應的催化劑
C. 增大Br2(g)濃度能增大活化分子百分數,加快反應速率
D. 正反應的活化能比逆反應的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組用只含有銅、鋁、鐵的工業廢料來制備硫酸銅和硫酸鋁晶體,實驗流程如下:
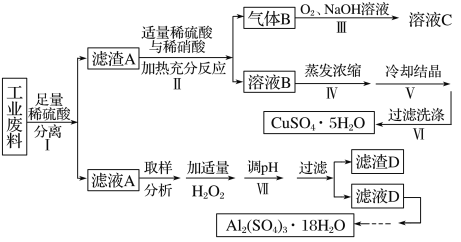
請回答:
(1)寫出步驟Ⅲ中氣體B與O2(足量)通入NaOH溶液中反應的化學方程式______。
(2)步驟Ⅳ蒸發濃縮的具體操作是________。
(3)下列有關實驗說法正確的是________。(填編號)
A.減壓過濾使用的濾紙,為確保把所有的孔都覆蓋住,應使濾紙大于布氏漏斗內徑
B.為得到純凈的硫酸鋁晶體,采用加熱烘干的方式干燥
C.步驟Ⅵ洗滌沉淀時,關小抽氣泵,向布氏漏斗中加冰水沒過沉淀,并用玻璃棒攪拌
D.步驟Ⅴ為得到較大的硫酸銅晶體顆粒,可投入幾粒晶種并減緩溶液冷卻速度
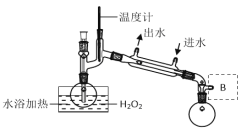
(4)H2O2濃度對反應速率有影響。通過下圖所示裝置將少量30% H2O2溶液濃縮至40%,B處應增加一個設備,該設備的作用是____。
(5)為測定實驗所得硫酸鋁晶體的純度,進行以下實驗:
步驟一:取晶體試樣a g溶于20 mL水中,加適量醋酸—醋酸銨緩沖溶液,再加入過量的c1mol·L-1EDTA溶液V1mL,充分反應后稀釋至250 mL。
步驟二:取25.00 mL上述稀釋液,滴加指示劑,用c2mol·L-1ZnCl2溶液滴定過量的EDTA,達到終點時消耗V2mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666 g·mol -1,EDTA分別能與Al3+或Zn2+以物質的量之比1∶1進行反應。
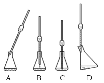
①在步驟二取上述稀釋液25.00 mL于錐形瓶中,有下圖所示操作(手持部分省略),其中正確的是____。(填編號)取溶液所用儀器的名稱是____
②根據實驗數據計算該試樣中Al2(SO4)3·18H2O的純度為____(用含字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的鎂和銅組成的混合物加入到足量的稀硝酸中,金屬完全溶解(假設反應中還原產物只有NO)。向反應后的溶液中加3mol/LNaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1g。下列敘述錯誤的是
A. 當金屬全部溶解時,電子轉移的數目為0.3NA
B. 參加反應的金屬的總質量3.6g<w<9.6g
C. 當金屬全部溶解時,產生的NO氣體的體積在標準狀況下為2.24L
D. 當生成的沉淀量達到最大時,消耗NaOH溶液的體積為l00mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一定量的鐵與足量的CuO制單質銅,有人設計了以下兩種方案:
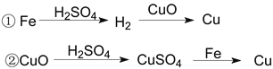
若按實驗原則進行操作,則兩者制得單質銅的量為 ( )
A.一樣多B.①多C.②多D.無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列實驗過程完成后,最終的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)3溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.無色溶液![]() 無沉淀
無沉淀![]() 白色沉淀
白色沉淀
D.無色溶液![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)“電解”所用食鹽水由粗鹽水精制而成,精制時,為除去Mg2+和Ca2+,要加入的試劑分別為________、________。
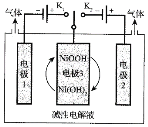
(2)氫能源是最具應用前景的能源之一,高純氫制備是目前的研究熱點。可利用太陽能光伏電池電解水制高純氫,工作示意圖如下。通過控制開關連接K1或K2,可交替得到H2和O2。
①制H2時,連接_______________(填K1或者K2)。產生H2的電極反應式是_____________。
②改變開關連接方式,可得O2,寫出制備氧氣時電極3對應的電極反應式是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氫氧燃料電池是符合綠色化學理念的新型發電裝置。如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定。其正極反應方程式為________________________,若將負極材料改為CH4,寫出其負極反應方程式_________________________。
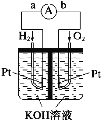
(2)以NH3代替氫氣研發燃料電池是當前科研的一個熱點。使用的電解質溶液是2molL﹣1的KOH溶液,電池總反應為:4NH3+3O2=2N2+6H2O。該電池負極的電極反應式為____________________;每消耗3.4g NH3轉移的電子數目為_________。
(3)圖為青銅器在潮濕環境中因發生電化學反應而被腐蝕的原理示意圖。

①腐蝕過程中,負極是_______(填圖中字母“a”或“b”或“c”);
②環境中的Cl- 擴散到孔口,并與正極反應產物和負極反應產物作用生成多孔粉狀銹Cu2(OH)3Cl,其離子方程式為______________;
③若生成4.29 g Cu2(OH)3Cl,則理論上耗氧體積為_______L(標況)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com