
 研究NOx、SO2、CO等大氣污染氣體的處理方法具有重要意義.
研究NOx、SO2、CO等大氣污染氣體的處理方法具有重要意義.分析 (1)注明物質的聚集狀態與反應熱書寫熱化學方程式;
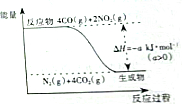
(2)發生反應:4CO+2NO2=N2+4CO2,計算CO物質的量,根據C元素化合價變化計算轉移電子;由圖可知4mol CO反應時放出熱量為a kJ,進而計算放出熱量;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4還原NO2至N2整個過程中放出的熱量為867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1.
解答 解:(1)已知1molCO(g)與適量的SO2(g)反應生成S(s)和CO2(g)時,放出135kJ的熱量,因此反應的熱化學方程式為:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol,
故答案為:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol;
(2)發生反應:4CO+2NO2=N2+4CO2,CO物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,根據C元素化合價變化可知轉移電子為0.1mol×2=0.2mol;由圖可知4mol CO反應時放出熱量為a kJ,則0.1mol CO反應放出的熱量為a kJ×$\frac{0.1mol}{4mol}$=0.025a kJ,
故答案為:0.025a;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4還原NO2至N2整個過程中放出的熱量為867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,則(-574KJ•mol-1+△H2)×$\frac{1}{2}$=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案為:-1160KJ/mol.
點評 本題考查反應熱有關計算、熱化學方程式書寫等,注意對蓋斯定律理解與靈活應用.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氯分子的電子式:Cl:Cl | B. | 水分子的電子式: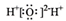 | ||
| C. | 氯離子的結構示意圖: | D. | 質量數為37的氯原子:${\;}_{37}{\;}^{17}Cl$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=4.3的CH3COOH與CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 濃度為0.2mol/L的CH3COOH溶液和農地為0.1mol/L的NaOH溶液等體積混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀釋,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$幾乎不變 | |
| D. | amol/LCH3COOH溶液與bmol/LNaOH溶液等體積混合,所得溶液中c(Na+)>c(CH3COO-),則一定有a≤b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素A的一種單質是太陽能電池中的主要材料 | |
| B. | 元素C的某單質與過氧化鈉的漂白原理類似 | |
| C. | B和E可組成一種耐高溫的結構材料,其化學式為E4B3 | |
| D. | 工業上制取E單質時,生成的氣體主要是AO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水制取氫氣 | |
| B. | 大量設立水電站,用電力分解水制取氫氣. | |
| C. | 設法將太陽能聚焦,產生高溫,使水分解產生氫氣. | |
| D. | 尋找更多的化石燃料,利用其燃燒放熱,使水分解產生氫氣. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質在水中一定能全部溶解 | |
| B. | Cu能導電,因此Cu是電解質 | |
| C. | 弱電解質溶液的導電性可能比強電解質溶液的導電性強 | |
| D. | NaCl是電解質,故NaCl固體能導電 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com