
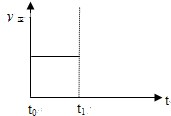
| 容器編號 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |

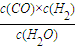 ,則K值增大,
,則K值增大,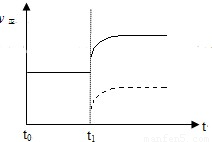 ,故答案為:
,故答案為: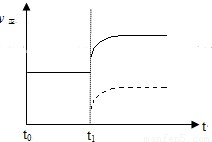 ;
;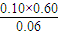 =
=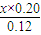 ,解得x=0.60mol/L,
,解得x=0.60mol/L,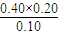 <K=
<K=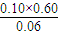 ,化學平衡正向移動,即正反應速率大于逆反應速率,
,化學平衡正向移動,即正反應速率大于逆反應速率,

 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
 水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:
水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:| 容器編號 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 0.6 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2009?廣州模擬)水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:
(2009?廣州模擬)水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:| 容器編號 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 0.60 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
查看答案和解析>>
科目:高中化學 來源:2010屆江蘇啟東中學高三考前輔導訓練化學試題 題型:計算題
水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
(1)實際工業生產中,向炭層間隔交替通入水蒸氣和空氣,其中通入空氣的原因是由于該反應是吸熱,導致炭層溫度降低,須及時通入富氧空氣促進炭層的燃燒放熱:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
為保持生產的連續性,若不考慮其它熱量的產生和損耗,則每間隔應通入的水蒸氣和空氣的體積比(同溫同壓)約為多少?(設空氣中氧氣的體積占1/5)
(2)一定溫度下,三個容器中均進行著上述反應①,各容器中炭足量,其它物質的物質的量濃度及正逆反應速率關系如下表所示。請填寫表中相應的空格。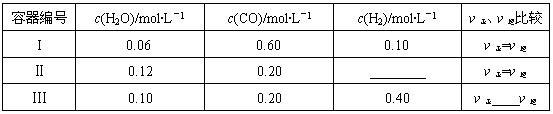
(3)生物乙醇可由淀粉或纖維素等生物質原料發酵獲得。利用乙醇可進而獲得合成氣(CO、H2)。用乙醇生產合成氣有如下兩條路線:
a、水蒸氣催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物質能研究所準備利用乙醇得到的合成氣合成一種生物汽油。乙醇各分一半按a、b兩式反應。合成氣合成生物汽油的反應為:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y兩種成分,且X、Y都是有8個碳原子的烴,X是苯的同系物,Y是烷烴。
①X的分子式為 ,Y的分子式為 。
②50噸質量分數為92%的乙醇經上述轉化(假定各步轉化率均為100%),則最終可獲得X的質量為多少噸?
查看答案和解析>>
科目:高中化學 來源: 題型:
水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的炭層制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H = +131.3 kJ•mol-1
CO (g) +H2 (g) △H = +131.3 kJ•mol-1
(1)該反應的平衡常數K隨溫度的升高而___________(增大 / 減小 / 不變)。
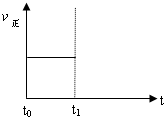
 (2)上述反應在t0時刻達到平衡(如下圖),若在t1時刻改變某一條件,請在下圖中繼續畫出t1時刻之后正反應速率(ν正)隨時間的變化:
(2)上述反應在t0時刻達到平衡(如下圖),若在t1時刻改變某一條件,請在下圖中繼續畫出t1時刻之后正反應速率(ν正)隨時間的變化:
① 縮小容器體積(用實線表示)
② 降低溫度(用虛線表示)
(3)一定溫度下,三個容器中均進行著上述反應,各容器中炭足量,其它物質的物質的量濃度及正逆反應速率關系如下表所示。請填寫表中相應的空格。
| 容器編號 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ________ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正____ν逆 |
(4)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若將24g炭完全轉化為水煤氣,然后再充分燃燒,整個過程的焓變為△H = kJ/mol。
查看答案和解析>>
科目:高中化學 來源:2008-2009學年江蘇省泰州市高二(下)期末化學試卷(解析版) 題型:解答題
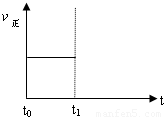
| 容器編號 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com