
【題目】金屬晶體和離子晶體是重要晶體類型。下列關于它們的說法中正確的是
A. 金屬晶體和離子晶體都能導電
B. 在鎂晶體中,1個Mg2+只與2個價電子存在強烈的相互作用
C. 金屬晶體和離子晶體都可采取緊密堆積方式
D. 金屬晶體和離子晶體中分別存在金屬鍵和離子鍵等強烈的相互作用,很難斷裂,因而都具有延展性
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】實驗室用含有雜質(FeO、Fe2O3)的廢CuO制備膽礬晶體經歷下列過程(已知:Fe3+在pH=5時已完全沉淀):
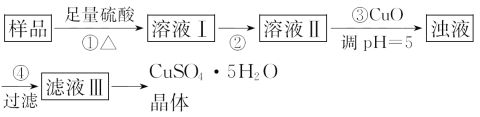
下列分析正確的是( )
A.用98%的濃硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,需4種玻璃儀器
B.步驟②目的是將溶液Ⅰ中的Fe2+充分轉化成Fe3+,實驗操作是向溶液Ⅰ中通入足量的氯氣
C.利用Cu(OH)2替代CuO也可調節溶液pH而不影響實驗結果
D.步驟④之后的實驗操作是蒸干溶劑結晶,所需儀器是蒸發皿、玻璃棒、酒精燈、泥三角、三腳架
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成。
(1)實驗室中常用來制備氯氣的化學方程式為__________________________________。
(2)實驗室中可用氯仿(CHCl3)與雙氧水直接反應制備光氣,其反應的化學方程式為________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究影響化學反應速率的因素,現設計如圖所示兩組對比試驗:

(1)第1組:實驗目的是探究________對化學反應速率的影響。
(2)第2組:甲中電流表指針偏轉程度更大,說明反應物濃度越大,化學反應速率_____(“越大”“越小”)
(3)第2組甲中,當放出2.24L(標準狀況)氣體時,理論上消耗的鋅的質量是____ g;
(4)甲烷-氧氣燃料電池的工作原理如圖所示:

①該電池工作時,a處(左側)通入的物質為_______,b處(右側)通入的物質為_____。
②該電池負極的電極反應式為________________。
③工作一段時間后,當12.8 g甲烷完全反應時,發生電子轉移數目為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2 L的密閉容器中,X、Y、Z三種氣體隨時間變化的曲線如圖所示。
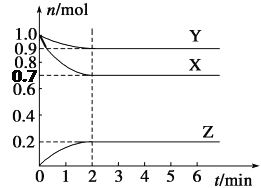
請回答下列問題:
(1)由圖中數據分析:該反應的化學方程式為__________________________。
(2)反應開始至2 min,Z的平均反應速率為________。
(3)5 min時Z的生成速率與6 min時Z的生成速率相比較,前者________后者(填“大于”、“小于”或“等于”)。
(4)上述反應過程中,如果降低溫度,則其反應速率________(填“增大”、“減小”或“不變)。
如果使用合適的催化劑,則其反應速率________ (填“增大”、“減小”或“不變)。
(5)下列各項中不可以說明上述反應達到平衡的是________(填字母)。
a.混合氣體的密度不變
b.混合氣體的壓強不變
c.同一物質的正反應速率等于逆反應速率
d.X的濃度保持不變
e.生成1 mol Z和同時生成1.5 mol X
f.X、Y、Z的反應速率之比為3∶1∶2
(6)在四種不同的條件下測定得到以下反應速率,其中表示的反應速率最快的是______。
①v(X)=0.6 mol·L-1·min-1 ②v(Y)=0.2 mol·L-1·min-1
③v(Z)=0.1 mol·L-1·s-1 ④v(Z)=0.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏伽德羅常數的值,下列敘述正確的是
為阿伏伽德羅常數的值,下列敘述正確的是
A. 常溫下,![]() 的
的![]() 溶液中氮原子數為0.2
溶液中氮原子數為0.2![]()
B. 在密閉容器中加入1.5 mol H2和0.5 molN2,充分反應后可得到NH3分子數為NA
C. 在反應KIO3+6HI=KI+3I2+3H2O中,每生成3![]()
![]() 轉移的電子數為6
轉移的電子數為6![]()
D. 標準狀況下,22.4 L的CCl4中C—Cl鍵數為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO2的利用對促進低碳社會的構建具有重要意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJmol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
則CO還原Fe2O3(s)的熱化學方程式為_____。
(2)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定體積CO2和H2的混合氣體(物質的量之比為1:3),加入恒容密閉容器中,發生上述反應反應過程中測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系如圖1所示,則該反應的△H____0(填“>”、“<”或“=”,下同)。
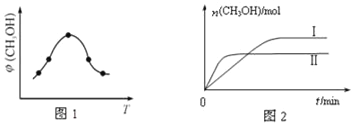
②在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖2所示,曲線I、Ⅱ對應的平衡常數關系為KⅠ_____KⅡ。
(3)以CO2為原料還可以合成多種物質。
①工業上尿素[CO(NH2)2]由CO2和NH3在一定條件下合成.開始以氨碳比![]() =3進行反應,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為_____。
=3進行反應,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為_____。
②將足量CO2通入飽和氨水中可得氮肥NH4HCO3,已知常溫下一水合氨Kb=1.8×10﹣5,碳酸一級電離常數Ka=4.3×10﹣7,則NH4HCO3溶液呈_____(填“酸性”、“中性”或“堿性”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com