
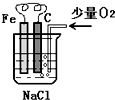
 分析圖,按要求寫出有關反應方程式:
分析圖,按要求寫出有關反應方程式:分析 由碳棒、鐵片和氯化鈉溶液組成的原電池中,Fe為負極,負極上Fe失電子生成亞鐵離子,碳棒為正極,氧氣在正極上得電子生成氫氧根離子,亞鐵離子與氫氧根離子結合生成氫氧化亞鐵,氫氧化亞鐵被氧氣氧化生成氫氧化鐵,據此分析.
解答 解:(1)由碳棒、鐵片和氯化鈉溶液組成的原電池中,Fe為負極,負極上Fe失電子生成亞鐵離子,碳棒為正極,氧氣在正極上得電子生成氫氧根離子,碳棒上的電極反應式為:2H2O+O2+4e-═4OH-;
故答案為:2H2O+O2+4e-═4OH-;
(2)溶液中亞鐵離子與氫氧根離子結合生成氫氧化亞鐵,氫氧化亞鐵被氧氣氧化生成氫氧化鐵,則溶液中發生的反應為2Fe+2H2O+O2═2Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案為:2Fe+2H2O+O2═2Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
點評 本題考查了金屬的電化學腐蝕及原電池原理,明確鋼鐵所處環境的酸堿性即可確定其電化學腐蝕類型,題目難度不大,注意把握電極方程式的書寫方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題

| A. | a、b、c的簡單離子中,a的離子半徑最大 | |
| B. | c、d、f最高價氧化物對應的水化物兩兩之間均可發生反應 | |
| C. | e的氫化物比f的氫化物的穩定性高 | |
| D. | a、e可形成一種新型無機非金屬材料--高溫結構陶瓷 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,32 g O2含有氧原子數為NA | |
| B. | 標準狀況下,22.4 L H2O含有的分子數為NA | |
| C. | 18g H2O中含有的電子數為10NA | |
| D. | 0.5mol•L-1CaCl2溶液中含Cl-數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下,電離平衡常數越小,表示弱電解質的電離能力越弱 | |
| B. | 相同條件下,化學平衡常數越大,表示該反應的反應速率越大 | |
| C. | 其它條件不變時,升高溫度,化學平衡常數一定增大 | |
| D. | 多元弱酸各步電離平衡常數相互關系為K1<K2<K3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用過濾法除去Na2SO4溶液中的泥沙 | B. | 用蒸餾法分離溶液中的KCl和KNO3 | ||
| C. | 用萃取法將碘水中的I2萃取出來 | D. | 用蒸發法從NaCl溶液中得到NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com