
 FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小,請回答下列問題:
FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小,請回答下列問題:分析 (1)Fe3+水解生成的Fe(OH)3膠體粒子能吸附水中的懸浮雜質,可起到凈水的作用;鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子;
(2)①根據(jù)電荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-濃度很小,在這里可以忽略不計),據(jù)此溶液中氫離子的濃度,再根據(jù)pH=-lgc(H+)計算;
②氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據(jù)得失電子守恒,則氯酸根離子的系數(shù)為1,F(xiàn)e2+的系數(shù)為6,則鐵離子的系數(shù)也是6,氯離子的系數(shù)是1,根據(jù)電荷守恒,則氫離子的系數(shù)是6,水的系數(shù)是3;
(3)鐵離子的水解分為三步,且水解程度逐漸減弱,所以水解平衡常數(shù)逐漸減小;
控制條件使平衡正向移動,水解為吸熱反應,所以降溫平衡逆向移動;加水稀釋,則水解平衡也正向移動;加入氯化銨,氯化銨溶液為酸性,氫離子濃度增大,平衡逆向移動;加入碳酸氫鈉,則消耗氫離子,平衡正向移動;
從反應的離子方程式中可知,氫離子的濃度影響高濃度聚合氯化鐵的生成,所以關鍵步驟是調(diào)節(jié)溶液的pH;
(4)由圖象可知,聚合氯化鐵的濃度在18~20 mg•L-1時,去除率達到最大值,污水的渾濁度減小.
解答 解:(1)Fe3+水解生成的Fe(OH)3膠體粒子能吸附水中的懸浮雜質,可起到凈水的作用;鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子,離子方程式是:2Fe3++Fe=3Fe2+,
故答案為:Fe3+水解生成的Fe(OH)3膠體粒子能吸附水中的懸浮雜質;2Fe3++Fe=3Fe2+;
(2)①根據(jù)電荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-濃度很小,在這里可以忽略不計),則c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,則溶液pH=-lg1.0×10-2=2,
故答案為:2;
②氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據(jù)得失電子守恒,則氯酸根離子的系數(shù)為1,F(xiàn)e2+的系數(shù)為6,則鐵離子的系數(shù)也是6,氯離子的系數(shù)是1,根據(jù)電荷守恒,則氫離子的系數(shù)是6,水的系數(shù)是3,配平后離子方程式為:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案為:1;6;6H+;1;6;3H2O;
(3)鐵離子的水解分為三步,且水解程度逐漸減弱,所以水解平衡常數(shù)逐漸減小,則K1>K2>K3;
控制條件使平衡正向移動,使平衡正向移動,因為水解為吸熱反應,所以降溫,平衡逆向移動;加水稀釋,則水解平衡也正向移動;加入氯化銨,氯化銨溶液為酸性,氫離子濃度增大,平衡逆向移動;加入碳酸氫鈉,則消耗氫離子,所以氫離子濃度降低,平衡正向移動,故選bd;
從反應的離子方程式中可知,氫離子的濃度影響高濃度聚合氯化鐵的生成,所以關鍵步驟是調(diào)節(jié)溶液的pH,
故答案為:K1>K2>K3;bd;調(diào)節(jié)溶液的pH;
(4)由圖象可知,聚合氯化鐵的濃度在18~20 mg•L-1時,去除率達到最大值,污水的渾濁度減小,
故答案為:18~20.
點評 本題考查鐵的化合物性質的應用、氧化還原反應方程式的配平、對圖象的分析能力、平衡移動影響因素等,需要學生具備扎實的基礎與靈活運用難度,難度中等.


科目:高中化學 來源: 題型:解答題
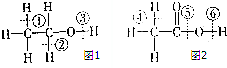 (1)乙醇分子的結構式可表示如圖1,在乙醇和鈉反應時,③(填序號,下同)鍵斷裂,在Cu催化和加熱條件下與O2反應時,①②鍵斷裂.
(1)乙醇分子的結構式可表示如圖1,在乙醇和鈉反應時,③(填序號,下同)鍵斷裂,在Cu催化和加熱條件下與O2反應時,①②鍵斷裂.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 銅電極上發(fā)生氧化反應 | |
| B. | 電池工作一段時間后,甲池的c(SO42-)減小 | |
| C. | 電池工作一段時間后,乙池溶液的總質量增加 | |
| D. | 陰陽離子分別通過交換膜向負極和正極移動,保持溶液中電荷平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子最外層電子數(shù)由多到少的順序:Y、X、W、Z | |
| B. | 原子半徑由大到小的順序:W、Z、Y、X | |
| C. | 元素非金屬性由強到弱的順序:Z、W、X | |
| D. | 簡單氣態(tài)氫化物的穩(wěn)定性由強到弱的順序:X、Y、W |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 在NaOH水溶液中加熱,化合物X可發(fā)生消去反應 | |
| B. | 在一定條件,化合物Y可與HCHO發(fā)生縮聚反應 | |
| C. | 用FeCl3溶液可鑒別化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
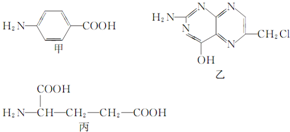 葉酸是維生素B族之一,可以由下列甲、乙、丙三種物質合成.
葉酸是維生素B族之一,可以由下列甲、乙、丙三種物質合成.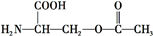 .
.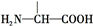
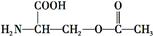 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com