
【題目】研究表明,中藥血必凈注射液對冠狀病毒導致的炎癥反應有抑制作用,其主要成分為紅花等中藥材提取物。紅花中含有的一種物質結構如圖,下列有關該物質的說法不正確的是
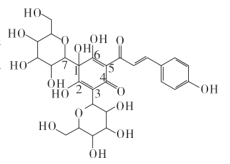
A.其分子式為C27H32O16B.其分子中含有5種官能團
C.能發生酯化反應和加成反應D.其分子中1~7號碳原子不在同一平面內
科目:高中化學 來源: 題型:
【題目】下圖是通過熱化學循環在較低溫度下由水或硫化氫分解制備氫氣的反應系統原理。

下列說法不正確的是( )
A. 通過計算,可知系統(Ⅰ)制備氫氣的熱化學方程式為:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1
B. 通過計算,可知系統(Ⅱ)制備氫氣的熱化學方程式為:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1
C. 若反應H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1 , 則a>286
D. 制得等量H2所需能量較少的是熱化學硫碘循環硫化氫分解法
查看答案和解析>>
科目:高中化學 來源: 題型:
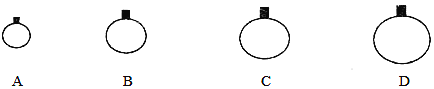
【題目】(1)常溫常壓下,用等質量的CH4、CO2、O2、SO2四種氣體分別吹出四個氣球,其中氣體為SO2的是_________(填選項序號)。
(2)在標準狀況下,2.24L由N2、N2O組成的混合氣體中含有的氮元素的質量約為_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物營養液中,c(K+)=0.7molL﹣1,c(Zn2+)=0.1molL﹣1,c(Cl﹣)=0.3molL﹣1,向混合溶液中滴加足量的BaCl2溶液后產生沉淀的物質的量為_________。
(4)0.3mol的甲烷與_________g氨氣中所含氫原子數相等。
(5)在同溫同壓下,2g二氧化碳的體積為120ml,而2gA氣體的體積為165ml,則氣體A的摩爾質量_________________;
(6)標準狀況下,11.2L二氧化碳和一氧化碳混合氣體的質量為18g,則其中二氧化碳的質量為_________,一氧化碳的體積為_________。
(7)氯氣(Cl2)、重鉻酸鉀(K2Cr2O7)是常用的氧化劑。
①硫代硫酸鈉(Na2S2O3)被稱為“養魚寶”,可降低水中的氯氣對魚的危害。已知25.0mL0.100molL﹣1 Na2S2O3溶液恰好把標準狀況下224mL的Cl2完全轉化為Cl﹣,則S2O32﹣將轉化成____________。
A.S2﹣ B.S C.SO32﹣ D.SO42﹣
②實驗室可用K2Cr2O7固體與濃鹽酸反應制備氯氣,發生反應的化學方程式為K2Cr2O7+14HCl(濃)=3Cl2↑+2CrCl3+2KCl+7H2O,若反應中轉移0.6mole﹣,則被氧化的HCl的物質的量為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實中,不能用勒夏特列原理解釋的是
A.氨水應密閉保存,放置于低溫處
B.對2HI(g) ![]() H2(g)+I2(g)平衡體系,增大平衡體系的壓強可使氣體顏色變深
H2(g)+I2(g)平衡體系,增大平衡體系的壓強可使氣體顏色變深
C.生產硝酸的過程中使用過量空氣以提高氨氣的利用率
D.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺
HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列方法適合實驗室制取氨氣的是( )
A.N2和H2催化加熱制取氨氣
B.加熱NH4Cl制取氨氣
C.將濃氨水加入到堿石灰固體中
D.將NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學科研小組研究在其他條件不變時,改變某一條件對化學平衡的影響,得到如下變化規律(圖中p表示壓強,T表示溫度,n表示物質的量):

根據以上規律判斷,下列結論正確的是( )
A.反應Ⅰ:ΔH>0,p2>p1B.反應Ⅱ:ΔH>0,T1>T2
C.反應Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反應Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,我國北京等地出現嚴重霧霾天氣,據研究,霧霾的形成與汽車排放的 CO、 NO2 等有毒氣體有關,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣 體,反 應方程式為4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)ΔH=-1200kJ/mol。對于該反應, 溫度不同(T2 > T1 )其他條件相同時,下列圖像正確的是
4CO2(g)+N2(g)ΔH=-1200kJ/mol。對于該反應, 溫度不同(T2 > T1 )其他條件相同時,下列圖像正確的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中的每一方格表示相關的一種反應物或生成物。其中B是一種單質,其余物質也都是含有B元素的化合物。C是一種鈉鹽,E是C對應的酸,B的結構類似金剛石,D為氧化物。
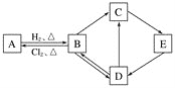
請回答下列問題:
(1)A、D、E的化學式分別為________、________、________。
(2)A和B的互相轉化在工業上有什么實際意義?_____________________。
(3)寫出D→C反應的化學方程式:_____________________。
(4)寫出E→D反應的化學方程式:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3 , 還含有少量MgO、SiO2等雜質)來制備,工藝流程如下:
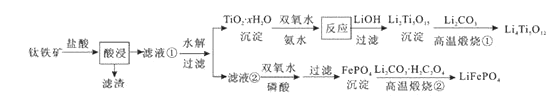
下列說法不正確的是( )
A.“酸浸”后,若鈦主要以TiOCl42-形式存在,則相應反應的離子方程式可表示為:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合價為+4,則其中過氧鍵的數目為3個
C.“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式可表示為:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀與雙氧水、氨水反應40min所得實驗結果如下表所示:
溫度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未達到平衡狀態,隨著溫度升高,轉化率變大;40 oC后,H2O2分解加劇,轉化率降低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com