
| ||
| 2min |
| 2 |
| 3 |


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ?mol-1 | 436 | 391 | 945 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ?mol-1 | 436 | 391 | 946 |
查看答案和解析>>
科目:高中化學 來源: 題型:
(11分)已知:298K時,N2(g)+3H2(g)![]() 2NH3(g) △H = -92.2kJ·mol—1。
2NH3(g) △H = -92.2kJ·mol—1。
(1)若N≡N的鍵能為941.3 kJ·mol—1,H-H的鍵能為436.4 kJ·mol-1,則N-H的鍵能為 ▲ 。
(2)實驗室將1.1mol N2、3mol H2充入2 L容器,一定條件下反應。
①若2 min末測得H2的物質的量為1.8 mol,則該時間段內氨氣的平均反應速率為 ▲ 。
②下列措施可加快該反應速率的是 ▲ 。
A.充入He氣 B.使用恰當的催化劑
C.升高反應體系的溫度 D.再充入N2
③當下列物理量保持不變時,表明該反應一定處于化學平衡狀態的是 ▲ 。
A.容器內N2與H2的濃度比 B.容器內氣體密度
C.恒溫下入侵壓強 D.H2的物質的量
④充分反應后恢復到298K,反應w*w^w.k&s#5@u.c~o*m過程中放出的熱量 ▲ 92.2kJ(填“>”、“=”、“<”),理由 ▲ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
I.光伏組件采用高效率單晶硅或多晶硅光伏電池、高透光率鋼化玻璃、抗腐蝕鋁合多邊框等材料,使用先進的真空層壓工藝及脈沖焊接工藝制造。
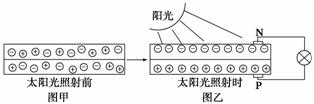
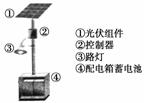 (1)下圖是太陽能電池板經太陽光照射前后內部電子的變化情況,圖乙中燈泡變亮,其中____(填寫“N”或“P”)是正極。
(1)下圖是太陽能電池板經太陽光照射前后內部電子的變化情況,圖乙中燈泡變亮,其中____(填寫“N”或“P”)是正極。
![]() (2)右上圖是一個太陽能路燈,圖中的④是蓄電池。鎳氫電池就是這樣一種與太陽能電池配套使用的蓄電池,白天用于充電,夜間供電。這種蓄電池容量大,充電放電循環壽命也較長。該蓄電池的總反應為Ni(OH)2 NiOOH+1/2H2↑。鎳氫電池的電解液采用30%的KOH溶液,白天充電反應時的陽極反應式為 ,夜間放電時,負極附近溶液的pH________(填“增大”、“減小”或“不變”)。
(2)右上圖是一個太陽能路燈,圖中的④是蓄電池。鎳氫電池就是這樣一種與太陽能電池配套使用的蓄電池,白天用于充電,夜間供電。這種蓄電池容量大,充電放電循環壽命也較長。該蓄電池的總反應為Ni(OH)2 NiOOH+1/2H2↑。鎳氫電池的電解液采用30%的KOH溶液,白天充電反應時的陽極反應式為 ,夜間放電時,負極附近溶液的pH________(填“增大”、“減小”或“不變”)。
 II.X、Y、Z、Q、R5種短周期元素原子序數依次增大。化合物甲由X、Z、Q3種元素組成,常溫下,0.1mol·L-l甲溶液的pH =13。工業上常用電解QR飽和溶液生產甲
II.X、Y、Z、Q、R5種短周期元素原子序數依次增大。化合物甲由X、Z、Q3種元素組成,常溫下,0.1mol·L-l甲溶液的pH =13。工業上常用電解QR飽和溶液生產甲
(3)Q的原子結構示意圖為
(4)常溫下將R的單質通人甲溶液中,發生反應的離子方程式為
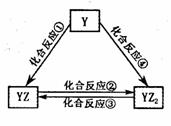
(5)若Y元素的單質能發生如右圖所示轉化,則Y元素是 。
已知:298K時,反應②生成1mol YZ2(g)時放出熱量283.O kJ·mol-1,
反應④生成1mol YZ2(g)時放出熱量393.5 kJ·mol-1,反應③的熱化學方程式為
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com