
【題目】設NA為阿伏加德羅常數的值.下列敘述錯誤的是
A.10g質量分數為46%的乙醇溶液中含有的氫原子數為0.6NA
B.28g乙烯和丙烯的混合氣體中含有的碳原子數為2NA
C.2.0gD2O中含有的質子數、電子數均為NA
D.在密閉容器中2molSO2和1molO2充分反應后,容器中含有的原子數為8NA
【答案】A
【解析】
A.10g質量分數為46%的乙醇溶液中含有的氫原子數大于0.6NA,水中也含有氫,故A錯誤;
B.乙烯C2H4,丙烯C3H6,不論按什么比例混合,碳氫原子比都是1:2,所以質量比都是12:2,所以28克氣體中碳原子占24克,也就是2摩爾,28g乙烯和丙烯的混合氣體中含有的碳原子數為2NA,故B正確;
C.1個D2O中含有10個質子,10個電子,則2.0g D2O物質的量為![]() =0.1mol,含有的質子數、電子數均為NA,故C正確;
=0.1mol,含有的質子數、電子數均為NA,故C正確;
D.根據質量守恒,在密閉容器中2molSO2和1molO2充分反應后,容器中含有的原子數為(3×2+2×1)NA=8NA,故D正確;
故選A。


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:
【題目】如圖所示,在A處通入未經干燥的氯氣。當關閉B閥時C處的紅布條看不到明顯現象;當打開B閥后,C處的紅布條逐漸褪色。則D瓶中盛放的溶液可能是( )
①飽和NaCl溶液②NaOH溶液③H2O④濃硫酸
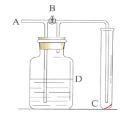
A.①B.①③C.②④D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為監測空氣中汞蒸氣是否超標,通過懸掛涂有CuI(白色)的濾紙,根據濾紙是否變色(亮黃色至暗紅色)及變色所需時間來判斷空氣中的汞含量。發生的化學反應為:4CuI+Hg=Cu2HgI4+2Cu。下列說法不正確的是
A.上述反應屬于置換反應
B.Cu2HgI4既是氧化產物又是還原產物
C.該反應中的氧化劑與還原劑的物質的量之比為2:1
D.當有1mol CuI參與反應時,轉移電子的物質的量為0.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某化工廠用氯氣與石灰乳生產漂白粉,該廠出廠產品說明書如下:

①漂白粉長期露置在空氣中會變質,寫出漂白粉變質過程中涉及的化學方程式______,____。
②某實驗室研究員將完全變質后的漂白粉溶于水,向其中加入足量稀硝酸,收集到標準狀況下448 mL氣體,則該漂白粉中所含有效成份的質量為_____________(假設漂白粉中的其它成份不與硝酸反應)。
(2)將14 g Na2O和Na2O2的混合物加入足量的水中充分反應后,生成標準狀況下的氣體1.12 L,所得溶液的體積為400 mL。試計算:原混合物中Na2O的質量為______g,所得溶液的物質的量濃度為______ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用鈦白工業的副產物硫酸亞鐵[含Ti(SO4)2及少量Fe2(SO4)3]制取鐵紅的工藝流程如圖所示。
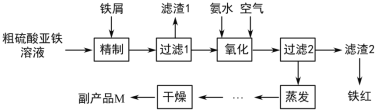
(1)加熱近沸條件下“精制”硫酸亞鐵的過程中,Ti4+會與水作用生成偏鈦酸(H2TiO3)沉淀,此反應的離子方程式為__________,加入鐵屑的作用是__________(用離子方程式表示)。
(2)“氧化”工序中發生反應的化學方程式有________。
(3)濾渣2能溶于酸和濃強堿,不溶于水。洗滌濾渣2最好選用的試劑是______(填寫序號)。
a 稀硫酸 b 稀鹽酸 c 濃NaOH溶液 d 蒸餾水
(4)副產品M的化學式為_________,由濾液得到M的操作為蒸發濃縮、_____、_____、洗滌、干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
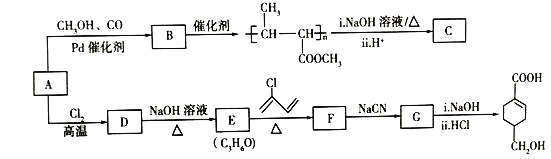
【題目】A(C3H6)是基本有機化工原料。由A制備聚合物C和![]() 的合成路線(部分反應條件略去)如圖所示:
的合成路線(部分反應條件略去)如圖所示:
已知:①![]() +
+![]() Δ
Δ![]() ;②R-C≡N
;②R-C≡N![]() R-COOH。
R-COOH。
回答下列問題:
(1)A的名稱是________
(2)C的結構簡式為_______
(3)![]() 發生縮聚反應的有機產物的結構簡式為________。
發生縮聚反應的有機產物的結構簡式為________。
(4)E→F的化學方程式為_______.
(5)B的同分異構體中,與B具有相同的官能團且能發生銀鏡反應的共有________種;其中核磁共振氫譜為3組峰,且峰面積之比為6:1:1的是________(寫結構簡式)。
(6)寫出用苯乙烯![]() 為原料制備化合物
為原料制備化合物![]() 的合成線路,其他無機試劑任選______。
的合成線路,其他無機試劑任選______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩同學分別設計實驗,測定CO2與Na2O2反應后的殘留物(成分為Na2O2、Na2CO3及少量不溶性雜質)中Na2O2的質量分數。
(1)甲同學設計的實驗流程如下:
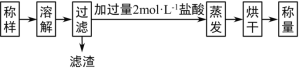
①試樣溶解過程中發生反應的化學方程式為_______。
②實驗中用12 molL-1鹽酸配制2molL-1鹽酸500mL,配制過程中用到的儀器有燒杯、玻璃棒、_____、______、_______,定容時俯視刻度線會使所配溶液濃度_____(填“偏高”“偏低”或“無影響”)。
③稱取試樣5.12 g,得濾渣0.10g,烘干得固體5.85g,則試樣中Na2O2的質量分數為___________%(保留1位小數)。
(2)乙同學利用如圖所示裝置進行實驗。

①實驗中應選取的試劑是_______________。
a 稀鹽酸 b 二氧化錳 c 蒸餾水 d 碳酸鈣
②裝置的連接順序應是_______________________(填各接口的字母,連接膠管略)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科學家利用二氧化鈰(CeO2)在太陽能作用下將H2O、CO2轉變成H2、CO。其過程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
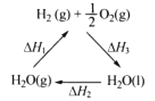
下列說法不正確的是
A. 該過程中CeO2沒有消耗
B. 該過程實現了太陽能向化學能的轉化
C. 右圖中△H1=△H2+△H3
D. 以CO和O2構成的堿性燃料電池的負極反應式為CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com