
實驗室用二氧化錳和濃鹽酸反應制取氯氣。
(1)若用200mL 10mol·L-1的濃鹽酸與足量的二氧化錳固體加熱反應(不考慮氯化揮發),則產生氯氣的物質的量為 0.50mol(填“大于”、“等于”或“小于”),原因是 。
(2)8.7g二氧化錳與足量的濃鹽酸反應,則被氧化的氯化氫的物質的量是多少?產生的氯氣在標準狀況下的體積是多少?
(8分)(1)小于 加熱過程濃鹽酸中HCl揮發掉部分;隨著反應進行,濃鹽酸變稀,稀鹽酸不與二氧化錳反應。(2)被氧化的氯化氫的物質的量為0.2 mol,產生的氯氣在標準狀況下的體積是2.24L
解析試題分析:(1)鹽酸的物質的量是0.2L×10mol/L=2mol,由于過程濃鹽酸中HCl揮發掉部分;隨著反應進行,濃鹽酸變稀,稀鹽酸不與二氧化錳反應,所以根據方程式MnO2 + 4H+ + 2Cl Mn2+ + 2H2O + Cl2↑可知,產生氯氣的物質的量為小于0.50mol。
Mn2+ + 2H2O + Cl2↑可知,產生氯氣的物質的量為小于0.50mol。
(2)8.7g二氧化錳的物質的量是8.7g÷87g/mol=0.1mol,則根據方程式可知
MnO2 + 4HCl(濃) MnCl2+ 2H2O + Cl2↑
MnCl2+ 2H2O + Cl2↑
1mol 4mol 22.4L
0.1mol 0.4mol 2.24L
所以被氧化的氯化氫的物質的量是0.4mol÷2=0.2mol
產生的氯氣在標準狀況下的體積是2.24L
考點:考查濃鹽酸和二氧化錳反應的有關計算
點評:該題是中等難度的試題,試題基礎性強,側重對學生基礎知識的鞏固和訓練,有利于培養學生的邏輯思維能力和發散思維能力。該的關鍵是明確稀鹽酸不能被二氧化錳氧化,然后具體問題、具體分析即可。


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
A、實驗室用二氧化錳和濃鹽酸制取氯氣:MnO2+4HCl
| ||||
B、銅與稀硝酸反應:Cu+4H++2N
| ||||
C、向氯化鋁溶液中通入過量氨氣:A13++4OH-?A1
| ||||
D、向Ca(OH)2溶液中加入過量NaHCO3溶液:Ca2++2HC
|
查看答案和解析>>
科目:高中化學 來源: 題型:
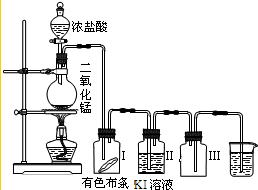 某同學實驗室用下列裝置探究氯氣的性質.
某同學實驗室用下列裝置探究氯氣的性質.查看答案和解析>>
科目:高中化學 來源: 題型:
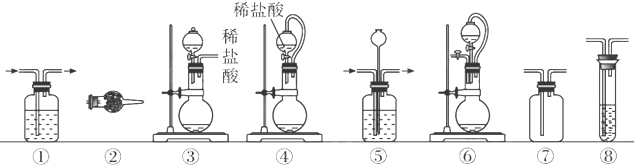
| 組合 | 制備裝置 | 凈化裝置 | 檢驗裝置/試劑 | 尾氣處理裝置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com