


科目:高中化學 來源: 題型:
 某學習小組為研究電化學原理,設計如圖裝置.下列敘述不正確的是( )
某學習小組為研究電化學原理,設計如圖裝置.下列敘述不正確的是( )| A、K與M、N均斷開時,該裝置中無反應發生 |
| B、K與M、N均斷開時,Zn表面有Cu析出 |
| C、K與M相連時,電流由銅片流向鋅片 |
| D、K與N相連時,銅片溶解,鋅片質量增加 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| n(CHOH) |
| n(CO) |
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1molCH3OH | 2molCH3OH |
| CH3OH的濃度(mol?L-1) | c1 | c2 | c3 |
| 反應的能量變化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 體系壓強(Pa) | P1 | P2 | P3 |
| 反應物轉化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
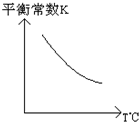 工業上利用反應:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制備H2.已知該反應的平衡常數K與溫度的關系如圖所示.若在一容積固定的密閉容器中,于850℃時發生上述反應,并測得容器內各物質的濃度(mol?L-1)隨時間的變化關系如下表:
工業上利用反應:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制備H2.已知該反應的平衡常數K與溫度的關系如圖所示.若在一容積固定的密閉容器中,于850℃時發生上述反應,并測得容器內各物質的濃度(mol?L-1)隨時間的變化關系如下表:| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
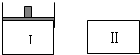 如圖,Ⅰ是恒壓密閉容器,Ⅱ是恒容密閉容器.其它條件相同時,在Ⅰ、Ⅱ中分別加入3molZ,起始時容器體積均為V L,發生如下反應并達到平衡(X、Y狀態未知):aX(?)+2Y(?)?3Z(g).此時Ⅱ中X、Y、Z的物質的量之比為1:2:2,則下列說法一定正確的是( )
如圖,Ⅰ是恒壓密閉容器,Ⅱ是恒容密閉容器.其它條件相同時,在Ⅰ、Ⅱ中分別加入3molZ,起始時容器體積均為V L,發生如下反應并達到平衡(X、Y狀態未知):aX(?)+2Y(?)?3Z(g).此時Ⅱ中X、Y、Z的物質的量之比為1:2:2,則下列說法一定正確的是( )| A、若X、Y均為氣態,則平衡時氣體平均摩爾質量:Ⅰ>Ⅱ |
| B、若X、Y不均為氣態,到達平衡后若在Ⅰ中再加入1molZ,則新平衡時Y的體積分數變大 |
| C、若X、Y均為氣態,則從起始到平衡所需時間:Ⅰ>Ⅱ |
| D、若X、Y不均為氣態,到平衡后若在Ⅱ中再加入2molZ,則新平衡時Z的體積分數變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、O2是還原產物 |
| B、NaOH是氧化產物 |
| C、Na2O2是氧化劑,水是還原劑 |
| D、Na2O2中,-1價的氧既得電子,又失電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com